| 物竞编号 | 0501 |
|---|---|
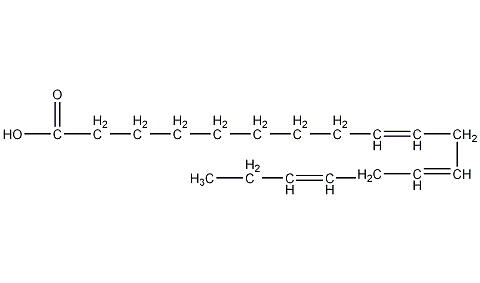
| 分子式 | C18H30O2 |
| 分子量 | 278.43 |
| 标签 | alpha-亚麻酸, (Z,Z,Z)9,12,15-十八碳三烯酸, α-Lnn, cis,cis,cis-9,12,15-Octadecatrienoic acid, 营养增补剂, 酸性溶剂 |
编号系统
CAS号:463-40-1
MDL号:MFCD00065720
EINECS号:207-334-8
RTECS号:暂无
BRN号:1727693
PubChem号:24896311
物性数据
1. 性状:无色至浅黄色的油状液体
2. 密度(g/ m3,25/4℃):0.9164
3. 熔点(ºC):-11~-10
4. 沸点(ºC,常压):230~232(2266pa)
5. 折射率(n20D):1.480
6. 闪点(ºC):>109
7. 溶解性:不溶于水,溶于许多有机溶剂。
毒理学数据
生态学数据
该物质对环境可能有危害,对水体应给予特别注意。
分子结构数据
1、 摩尔折射率:87.17
2、 摩尔体积(cm3/mol):301.1
3、 等张比容(90.2K):731.3
4、 表面张力(dyne/cm):34.8
5、 极化率(10-24cm3):34.56
计算化学数据
1、 疏水参数计算参考值(XlogP):5.9
2、 氢键供体数量1
3、 氢键受体数量2
4、 可旋转化学键数量:13
5、 互变异构体数量:
6、 拓扑分子极性表面积(TPSA):37.3
7、 重原子数量:20
8、 表面电荷:0
9、 复杂度:301
10、 同位素原子数量:0
11、 确定原子立构中心数量:0
12、 不确定原子立构中心数量:0
13、 确定化学键立构中心数量:3
14、 不确定化学键立构中心数量:0
15、 共价键单元数量:1
性质与稳定性
1. 按规格使用和贮存,不会发生分解,避免与氧化物接触。
2. 存在于烤烟烟叶、白肋烟烟叶、香料烟烟叶、烟气中。
3. 作为甘油酯存在于大多数干性油中。含三个双键的不饱和脂肪酸。
4. 氢化时先变为油酸、亚油酸和其异构体,再变为硬脂酸。加热时易聚合。
贮存方法
密闭避光充氮包装。贮存于阴凉避光处,注意防止氧化变质。密封保存,放置于通风、干燥地方,避免于其他氧化物接触。 贮存温度2~8ºC
合成方法
γ-亚麻酸天然存在于多种精油中,如月见草(Oenothera biennis L·)种子油中含7%~10 %,玻璃苣(borage)油中含18%~26%,黑醋栗(black currant)油中含量15%~20%。目前,国内外生产γ-亚麻酸的方法主要是从月见草油中提取。我国吉林延边等地已大面积种植月见草,其种子含油率约在15%~25%,其中γ-亚麻酸含量在7%~10%。
月见草油的提取可采用传统的冷榨法(提取率约10%),或溶剂萃取法(提取率18%~22%),也可采用新型的分离技术超临界CO2萃取法。月见草油可进一步经冷冻结晶(- 50℃)或尿素包合法精制。
微生物发酵法
γ-亚麻酸存在于某些细菌、真菌及微藻类的细胞内,占总脂肪酸的6%~24%。日本已具有较大的发酵法生产能力,我国也已进人工业化生产阶段。
亚油酸的制备 以油酸为原料,经去饱和,制得亚油酸。
油酸[去饱和]→亚油酸
亚麻酸的制备 亚油酸在ω-3脱氢酶的作用下生成α-亚麻酸;在ω-6脱氢酶的作用下生成γ-亚麻酸。
方法二、细菌定性发酵产生的菌丝体,用有机溶媒提取γ-亚麻酸甲酯
林红卫、覃海错从螺旋藻中分离和纯化γ-亚麻酸的方法:螺旋藻经丙酮-水 (体积比3:1)系统在65℃浸提30min后得到总类脂、总类脂用硝酸根-硅胶柱层析,其中的脂肪酸半乳糖酯被环烷-乙酸乙酯洗脱出来,蒸去溶剂后,在甲醇-氯乙酰的共同作用下,脂肪酸半乳糖酯转化为脂肪酸甲酯。后者与甲醇和尿素一起于65℃回流至澄清,在-15℃静置过夜,饱和脂肪酸甲酯和单不饱和脂肪酸甲酯形成尿素复合物结晶析出γ-亚麻酸甲酯留在母液中而被纯化出来。
方法三、尿素包合法制备α-亚麻酸乙酯
尿素的结晶呈四方体,当与直链脂肪酸共存时变为六面体晶体。直链的饱和脂肪酸最容易进入六面体晶体的管道内,而形成尿素包合物。而不饱和脂肪酸中的双键越多,越难进入晶体的管道内,双键使分子体积增大,较难形成尿素包合物。根据这个性质,可以将高不饱和脂肪酸与饱和的、低饱和的脂肪酸分开,达到分离纯化α-亚麻酸的目的。
紫苏油中含有α-亚麻酸、亚油酸、硬脂酸、棕榈酸等多种脂肪酸,其中α-亚麻酸的含量高达60%以上。
制备游离的混合脂肪酸 紫苏子经压榨、精制得到紫苏油。精密称取紫苏油200g,加入1mol/L氢氧化钾乙醇溶液1000ml,充氮水浴加热回流0.5-1h,使之完全皂化,得皂化液。回收乙醇,加入稀盐酸调pH1,充分搅拌后静置,分取上层油状液体,即为游离的混合脂肪酸。
紫苏油[KOH乙醇溶液]→[充氮水浴加液]皂化液[回收乙醇]→[pH1]混合游离脂肪酸
尿素包合法 精密称取游离的混合脂肪酸25g,加入5倍量乙醇和2倍量尿素,尿素分三次加入,加入量依次减少。每次加入尿素后,加热(60℃)搅拌,使尿素溶解。保温1h,先常温下静置12h,再-10℃静置12h,析出尿素包合物结晶,然后过滤除去结晶,滤液加入尿素进行下一次包合。反复3次,回收乙醇,制得包合后的脂肪酸。
混合游离脂肪酸[乙醇,尿素]→[适当温度][过滤]→包含后的脂肪酸
α-亚麻酸乙酯的制备 取包合后的脂肪酸加入2%的H2SO4-EtOH溶液,水浴70℃充氮加热回流2h至乙酯化反应完全,回收乙醇,加入石油醚萃取分液,分取醚层,水洗,无水硫酸钠干燥,充氮减压回收石油醚,制得α-亚麻酸乙酯,α-亚麻酸乙酯含量达80%以上。
包合后的脂肪酸[H2SO4-EtOH]→[充氮水浴加热][回收乙醇]→[石油醚萃取,洗涤][干燥,回收石油醚]→α-亚麻酸乙酯
尿素包合法制备多烯不饱和脂肪酸具有尿素可以回收,生产成本低,且操作方法简单的特点。制备多烯不饱和脂肪酸的方法除尿素包合法外,还有低温冷冻法、金属盐形成法、分子蒸馏法、高效液相法、脂肪酶法等多种方法。
方法四、尿素包合法富集γ-亚麻酸
脂肪酸的制备 取月见草油100g,加210.3g强碱溶液(组成:水 100g,氢氧化钠30g,EDTA0.3g,95%乙醇80g)在60℃水浴中搅拌30min,将皂化后的溶液取出、冷却,加蒸馏水40ml,加37%盐酸85ml,加正己烷100ml,振摇提取,回收正己烷,制得脂肪酸。
月见草油[强碱溶液]→[60℃, 30min]皂化液[冷却]→[加混合溶剂振摇]脂肪酸
尿素包合 取脂肪酸110g,按脂肪酸:尿素:甲醇=1:3.7:6.4(质量比)的比例加尿素和甲醇,水浴加热不断搅拌至尿素全部溶解,在室温下搅拌待温度降至58-60℃左右,置冷水浴中继续搅拌至溶液温度降至30℃左右,在冷水浴中加冰块,使溶液温度降至4℃以下,保持1h,抽滤,得滤液。将滤液中加37%盐酸50ml、水150ml、正己烷100ml,振摇、静置、分层。将下层滤液置烧杯内,再加50ml正己烷,振摇分层,分出下层滤液。将2次上层液合并,回收正己烷,制得γ-亚麻酸。富集前经气相色谱仪测定,γ-亚麻酸含量为10.35%;富集后经气相色谱仪测定,γ-亚麻酸含量为90.51%。
脂肪酸[混合溶液]→[适当温度]滤液[混合溶液]→[分层]上层溶液[回收溶剂]→γ-亚麻酸。
从月见草种子(含油脂20%~25%)等按常规方法榨油后分离,可同时分出70%~80%的亚油酸和10%~15%的γ-亚油酸。如经皱落假丝酵母脂肪酶处理二次,γ-亚油酸含量可由22.2%增至59.0%。
现代多采用微生物发酵法生产。如用丝状菌毛霉(Mucor circinelloides)、深黄被孢霉(Mortierella isabellina)三类培养(用葡萄糖为碳源)后得干燥菌丝体(可含油脂达35%,其中γ-亚麻酸占脂肪酸量的18%以上),用己烷提取毛油,然后再按一般方法精制而成。
为防止其氧化,成品需隔断阳光和空气密闭充氮包装后低温贮藏。最好直接用软胶囊包封。
用途
安全信息
危险运输编码:暂无
危险品标志: 易燃
易燃  刺激
刺激
危险标识:R36/37/38
文献
1. Koiwai A,Suzuki F, Matsuzaki T, et al. Phytochemistry, 1983, 22: 1409-1412. 2. Swain A P, Stedman R L. A. O. A. C., 1962, 45: 536-540. 3. Hoffmann D, Woziwodzki H. Beitr. Tabakforsch., 1968, 4: 167-175. 4. Walters D B,Chamberlan W J, Chortyk O T. Anal. Chim. Acta., 1975, 77: 309-311. 5. Chu H, Tso T C. Plant Physiol., 1968, 43: 428-433. 6. Tancogne J, Chouteau J. Ann. du Tabac Sect. 2, 1978, 15: 231-240.
备注
暂无







 沪公网安备 31010602001115号
沪公网安备 31010602001115号