| 物竞编号 | 01N0 |
|---|---|
| 分子式 | C8H18O3 |
| 分子量 | 162 |
| 标签 | 暂无 |
编号系统
CAS号:78-39-7
MDL号:MFCD00009223
EINECS号:201-112-4
RTECS号:暂无
BRN号:506201
PubChem号:24886849
物性数据
1. 性状:无色有特殊气味液体
2. 密度(g/mL,25/4℃):0.8847
3. 常温折射率(n20):1.3968
4. 熔点(ºC):74-78
5. 沸点(ºC,常压):144~146℃
6. 沸点(ºC,5.2kPa):47~45℃(1.60kPa)
7. 折射率:1.3949
8. 闪点(ºC):55℃
9. 比旋光度(º):不确定
10. 自燃点或引燃温度(ºC):不确定
11. 蒸气压(kPa,25ºC):不确定
12. 饱和蒸气压(kPa,60ºC):不确定
13. 燃烧热(KJ/mol):不确定
14. 临界温度(ºC):不确定
15. 临界压力(KPa):不确定
16. 油水(辛醇/水)分配系数的对数值:不确定
17. 爆炸上限(%,V/V):不确定
18. 爆炸下限(%,V/V):不确定
19. 溶解性:不溶于冷水,与乙醇、醚、酸、酯、氯仿、四氯化碳混溶。
毒理学数据
暂无
生态学数据
暂无
分子结构数据
1、 摩尔折射率:44.31
2、 摩尔体积(cm3/mol):179.7
3、 等张比容(90.2K):404.5
4、 表面张力(dyne/cm):25.6
5、 极化率(10-24cm3):17.56
计算化学数据
1.疏水参数计算参考值(XlogP):1.3
2.氢键供体数量:0
3.氢键受体数量:3
4.可旋转化学键数量:6
5.互变异构体数量:无
6.拓扑分子极性表面积27.7
7.重原子数量:11
8.表面电荷:0
9.复杂度:76.3
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
对水敏感,需要干燥保存。
贮存方法
干燥保存。
合成方法
1.在无水乙腈、无水乙醇和无水乙醚的混合物中通入稍过量的干燥氯化氢制得。
2.乙酸亚胺甲基醚盐酸盐的制备 在冷却的135克无水乙睛、200毫升绝对乙醇和120毫升绝对乙醚的混合物中,通入稍超过摩尔量的千燥氯化氢。在冰箱中放置过夜后,混合物固化成为白色发光片状的块。倾去乙醚,在放有碱石灰的真空干燥器中使此盐酸盐干燥24小时,以除去过量的氯化氢。产率86-95%。 用甲醇代替乙醇进行此反应,得到白色发光片状的乙酸亚胺甲基醚盐酸盐,产率71.6%。
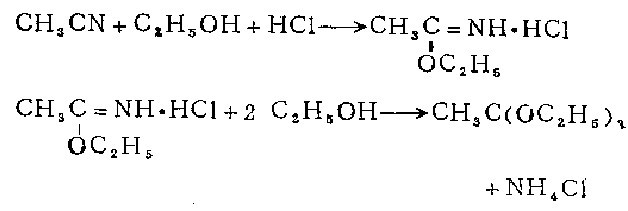
原乙酸三乙酯的制备 在350克绝对干燥而不含游离氯化氢的乙酸亚胺甲基醚盐酸盐中加入750毫升绝对乙醇。将此混合物盛于塞紧的瓶中,置千燥处放两星期,不时摇动。滤去析出的氯化按。这些氯化按要保留下来,因为乙醇与亚胺醚盐酸盐的反应极慢,故固体沉淀中还含有大量的未反应的盐酸盐。滤液用2克熔融过的碳酸钾处理以除去任何痕量的氯化氢,然后在40一60毫米的减压下分馏。第一馏分25-35℃,含绝对乙晾和一些原乙酸醋,可再用于氯化按沉淀 的和新的乙酞亚胺乙基醚盐酸盐的进一步处理。收集的沸点55-57℃/ 50mm馏分在常压下再分馏。纯原乙酸三乙醋的沸点为144-146℃而不分解。4次制备得750毫升纯产品。
用途
1.用于反式三取代烯及手性丙二烯等烯类制剂的制备及染料、制药工业的原料。
2.原乙酸三乙酯[1]在碱性条件下稳定,酸性条件下易反应,在比较温和的条件下通过酸催化水解生成酯和醇。它水解生成乙酸乙酯和乙醇,因此这类化合物在Fischer酯化反应中会与副产物水反应,生成低沸点的乙酸乙酯和乙醇,从而使平衡移动,促进酯化反应进行。原乙酸三乙酯可以引发烯丙醇的Claisen重排,因此常用于增长碳链。此外它还可以用于合成酰胺的反应。
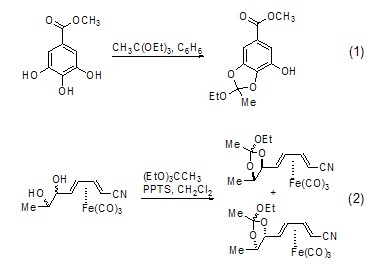
乙酸酯的合成 在无水条件下,一些醇也会与原乙酸三乙酯反应生成醚 (式1)[2]。一些金属配合物也可发生此类反应 (式2)[3]。
Claisen重排 在酸催化下,原乙酸三乙酯可以与烯丙醇反应生成C-C键 (式3)[4],其本质是烷氧基的Claisen重排。该反应可能生成多种手性异构体,具有一定的空间选择性 (式4)[5]。
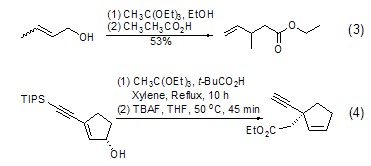
通过Claisen重排可以实现碳链的增长。由于重排产物为酯,可进一步还原为羟基,从而使碳链增长 (式5)[6]。

丙二烯的生成 原乙酸三乙酯可以与α-位取代的炔烃反应,生成具有丙二烯结构的酯 (式6)[7]。
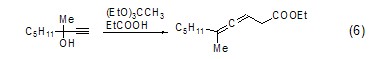
碳-碳双键的生成 原乙酸三乙酯可以作为亲核试剂进攻电子云密度较低的碳原子,形成碳-碳双键,例如它与1,3-丙二腈的反应 (式7)[8]。
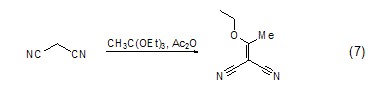
C-X键的形成 原乙酸三乙酯还可以与氨基等杂原子基团反应,形成C-N键或C=N双键 (式8)[9]。

安全信息
危险运输编码:UN 3272 3/PG 3
危险品标志: 刺激
刺激
安全标识:S26
文献
1. Paquette, L. A.; Ra, C. S.; Gallucci, J. C.; Kang, H.-J.; Ohmori, N.; Arrington, M. P.; David, W.; Brodbelt, J. S. J. Org. Chem., 2001, 66, 8629. 2. Alam, A, Takaguchi, Y, Ito, H, Yoshida, T, Tsuboi, S. Tetrahedron, 2005, 61, 1909. 3. Takemoto, Y.; Ishii, K.; Ibuka, T.; Miwa, Y.; Taga, T.; Nakao, S.; Tanaka, T.; Ohishi, H.; Kai, Y.; Kanehisa, N. J. Org. Chem., 2001, 66, 6116. 4. Hayes, P.; Fletcher, M. T.; Moore, C. J.; Kitching, W. J. Org. Chem., 2001, 66, 2530. 5. Sumi, S.; Matsumoto, K.; Tokuyama, H.; Fukuyama, T. Org. Lett., 2003, 5, 1891. 6. Avedissian, H.; Sinha, S. C.; Yazbak, A.; Sinha, A.; Neogi, P.; Sinha, S. C.; Keinan, E. J. Org. Chem., 2000, 65, 6035. 7. Jonasson, C.; Horvath, A.; Backvall, J.-E. J. Am. Chem. Soc., 2000, 122, 9600. 8. Markwalder, J. A.; Arnone, M. R.; Benfield, P. A.; Boisclair, M.; Burton, C. R.; Chang, C.-H.; Cox, S. S.; Czerniak, P. M.; Dean, C. L.; Doleniak, D.; Grafstrom, R.; Harrison, B. A.; Kaltenbach, R. F. III; Nugiel, D. A.; Rossi, K. A.; Sherk, S. R.; Sisk, L. M.; Stouten, P.; Trainor, G. L.; Worland, P.; Seitz, S. P. J. Med. Chem., 2004, 47, 5894. 9. Romeo, G.; Materia, L.; Manetti, F.; Cagnotto, A.; Mennini, T.; Nicoletti, F.; Botta, M.; Russo, F.; Minneman, K. P. J. Med. Chem., 2003, 46, 2877. 10.参考书:现代有机bepaly tw <性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无









 沪公网安备 31010602001115号
沪公网安备 31010602001115号