| 物竞编号 | 063X |
|---|---|
| 分子式 | C4H9LI |
| 分子量 | 64.05 |
| 标签 | Lithium-2-methyl-2-propanide, t-BuLi, bepaly tw |
编号系统
CAS号:594-19-4
MDL号:MFCD00008795
EINECS号:209-831-5
RTECS号:暂无
BRN号:3587204
PubChem号:24889995
物性数据
1. 性状:为使商品性质稳定,通常为正戊烷溶液。
2. 密度(g/mL,25/4℃): 0.652
3. 相对蒸汽密度(g/mL,空气=1):未确定
4. 熔点(ºC): 未确定
5. 沸点(ºC,常压):未确定
6. 沸点(ºC,5.2kPa):70
7. 折射率:未确定
8. 闪点(ºC):-6
9. 比旋光度(º):未确定
10. 自燃点或引燃温度(ºC):未确定
11. 蒸气压(kPa,25ºC):未确定
12. 饱和蒸气压(kPa,60ºC):未确定
13. 燃烧热(KJ/mol):未确定
14. 临界温度(ºC):未确定
15. 临界压力(KPa):未确定
16. 油水(辛醇/水)分配系数的对数值:未确定
17. 爆炸上限(%,V/V):未确定
18. 爆炸下限(%,V/V):未确定
19. 溶解性: 溶于正戊烷等。溶于烃类和醚类溶剂。
毒理学数据
暂无
生态学数据
暂无
分子结构数据
暂无
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:1
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:5
8.表面电荷:0
9.复杂度:8.4
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:2
性质与稳定性
叔丁基锂溶液暴露于空气或湿气时易起火。对叔丁基锂的操作应在无水无氧条件下进行,并穿戴好护目镜、防腐手套等安全装备。一旦着火,应用干粉灭火器扑灭,千万不可使用含水或氯代烷烃的灭火器。叔丁基锂参与的反应必须在隔绝空气和湿气的氮气或氩气保护下进行。由于反应会放热,因此应控制反应在低温下进行。
贮存方法
通常以1.7mol/L戊烷溶液形式贮存、销售及使用。
合成方法
1. 将锂与少量钠一起熔融于干燥的矿物油中,同时加儿滴油酸以防止锉沙粘结。激烈振荡几秒钟后冷却,在薄薄一层玻璃毛上过滤,用乙醚洗涤,然后将铿砂转移到1升的三颈中。此法制得的钮砂直径约1毫米,呈浅银灰色。
在三颈烧瓶上装置封闭式搅拌器、顶端有气体导入管的恒压滴液漏斗和与一个矿物油计泡计连接的气体导出管(计泡计用来指示氮气及其它气体的流通情况)。瓶上的玻璃接头都应涂上润沿脂。用袒丝做成的Hershberg搅拌器能更有效地搅动混合物,以避免铿砂被形成的盐所复盖或沉降于瓶底而不再继续反应。温度计经气体导管插入瓶中将三颈烧瓶置于干冰一丙酮浴中冷却,加300一400毫升乙醚。在一30℃一40℃和2一3小时内,滴加在室温下与乙醚等体积的叔丁基氯。控制温度不超过一30℃,以使反应顺利进行〔若超过一30℃,会产生更多的不饱和烃而急速逸出气体;但若过分冷却,如在一70℃,反应则很慢产率75%。也可用戊烷作溶剂0.2%的金属钠和青酮粉未作锉的活化剂来制备此试剂。
2. 通过叔丁基氯与1%~2%的钠-锂合金在干燥正戊烷溶剂中反应而来。
用途
1. 羰基化合物的烷基化。脱溴剂。有机合成。
2. 用于重要的锂试剂。通过卤素一金属交换反应而可用于制备其它有机铿化合物,如芳基铿、三烷基氢化硼锉、乙烯基锉、a一铿烷基苯硫醚、β一铿代烯胺等。在温和条件下还原拨基成怒基也是聚合反应的引发剂。
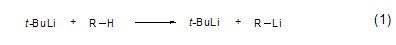
3.叔丁基锂相比正丁基锂和异丁基锂而言,具有更强的碱性和金属化活性以及更弱的亲核性,因此能够用于质子酸性更弱的烃类底物的脱质子锂化反应 (式1)[1]。通常,简单烷烃对于叔丁基锂仍然能保持惰性,但是对于含杂原子的溶剂如THF则会与叔丁基锂发生反应。
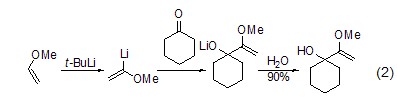
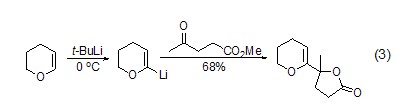
当底物是含杂原子如氧、氮、硫的化合物时,使用叔丁基锂作脱质子试剂能够获得很高的区域选择性。如乙烯基醚或环醚与叔丁基锂反应是一种简单制备α-锂化乙烯基醚的方法 (式2,式3)[2,3]。
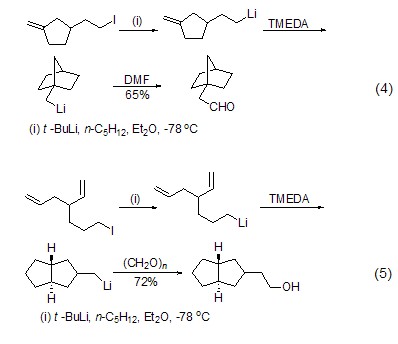
与其它烷基锂试剂类似,叔丁基锂对含杂原子取代基的芳烃化合物的锂化反应同样具有邻位锂化效应。在锂卤交换反应中,叔丁基锂由于其较弱的亲核性,因而相比正丁基锂和异丁基锂具有更大的优势。其中,锂-碘交换反应进行得最为完全、有效,如先在低温下与6-碘-1-己烯作用发生锂-碘交换,然后升温发生高立体选择性和区域选择性的5-外环化反应,进而被亲电试剂进攻得到官能化产物 (式4)[4]。类似的异构反应也可以用来制备多环化合物 (式5)[5]。
两当量的舒丁基锂与α,ω-二碘化合物在–23 oC反应能够经过α-锂-ω-碘代烷烃中间体,定量生成五元碳环化合物 (式6)[6]。
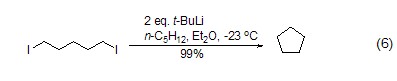
在乙醚或氨的存在下,叔丁基锂能够快速加成到烯烃上定量得到新己基锂 (式7)[7]。值得强调的是叔丁基锂对碳-碳双键的加成只有在以下几种情况下才能发生:(1) π-烯烃是共轭的;(2) 环状烯烃存在较大张力 (式8)[8];(3) 产生的阴离子能够被底物官能团稳定或支持;(4) 在烯丙基位存在好的离去基团。
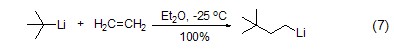
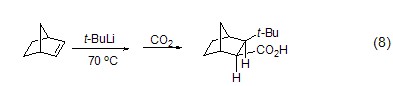
安全信息
危险运输编码:UN 3394 4.2/PG 1
危险品标志: 易燃
易燃  腐蚀
腐蚀  危害环境
危害环境
安全标识:S26 S43 S45 S36/S37/S39
危险标识:R11 R15 R17 R34 R38 R65 R67 R50/53
文献
1. (a) Wakefield, B. J. The Chemistry of Organolithium Compounds, Pergamon: Oxford, 1974. (b) Wakefield, B. J. Organolithium Methods, Academic: San Diego, 1990. (c) Wardell, L. J. In Comperhensive Organometallic Chemistry, Wilkinson, G., Ed.; Pergamon: Oxford, 1982, Chapetr 2. 2. Baldwin, J. E.; Hofle, G. A.; Lever, O. W. J. Am. Chem. Soc., 1974, 96, 7125. 3. Boeckman, R. K.; Bruza, K. J. Tetrahedron Lett., 1977, 4187. 4. Bailey, W. F.; Patricia, J. J.; Del Gobbo, V. C.; Jarret, R. M.; Okarma, P. J. J. Org. Chem., 1985, 50, 1999. 5. (a) Bailey, W. F.; Khanolkar, A. D.; Gavaskar, K. V. J. Am. Chem. Soc., 1992, 114, 8053. (b) Bailey, W. F.; Rossi, K. J. Am. Chem. Soc., 1993, 115, 3080. 6. (a) Bailey, W. F.; Gagnier, R. P.; Patricia, J. J. J. Org. Chem., 1984, 49, 2098. (b) Bailey, W. F.; Gagnier, R. P. Tetrahedron Lett. 1982, 23, 5123. 7. (a) Bartlett, P. D.; Friedman, S.; Stiles, M. J. Am. Chem. Soc., 1953, 75, 1771. (b) Bartlett, P.D.; Stiles, M. J. Am. Chem. Soc., 1955, 77, 2806. (c) Bartlett, P.D.; Tauber, S. J.; Weber, W. P. J. Am. Chem. Soc., 1969, 91, 6362. (d) Bartlett, P.D.; Goebel, C. V.; Weber, W. P. J. Am. Chem. Soc., 1969, 91, 7425. 8. Mulvaney, J. E.; Gardlund, Z. G. J. Org. Chem., 1965, 30, 917. 9.参考书:现代有机bepaly tw <性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无





 沪公网安备 31010602001115号
沪公网安备 31010602001115号