| 物竞编号 | 1D5K |
|---|---|
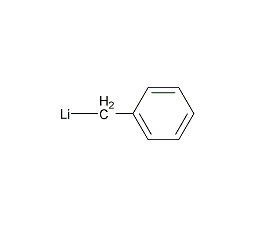
| 分子式 | C7H7Li |
| 分子量 | 98.07 |
| 标签 | 苯甲基锂 |
编号系统
CAS号:766-04-1
MDL号:暂无
EINECS号:暂无
RTECS号:暂无
BRN号:暂无
PubChem号:暂无
物性数据
1.性状:溶于醚类溶剂,可从正己烷重结晶。
毒理学数据
暂无
生态学数据
暂无
分子结构数据
暂无
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:1
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:8
8.表面电荷:0
9.复杂度:46.3
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:2
性质与稳定性
必须原位制备使用,制备或转移过程必须在惰性气体氛围下进行,一定注意隔绝空气和湿气。
贮存方法
暂无
合成方法
大规模制备可以采用苄基乙基醚与金属锂在THF/乙醚中反应完成。采用甲苯的直接金属化反应可以制备纯度较高的样品。也可通过金属置换反应由有机锡化合物制备而来。还可从苄基硒化物与丁基锂在-78℃反应而来。
用途
作为共振稳定的锂试剂,苄基锂具有很强的亲核活性,同时相比于烷基锂试剂具有更弱的碱性,使得它很容易发生碳上的亲核取代反应[1], 如与卤代烷系统发生的取代卤素的反应 (式1)[2]。此外,磷上的取代反应也报道,如光学活性醇金鸡纳宁可以从磷上被苄基锂取代,从而制备具有相反构象的光学活性磷化合物 (式2)[3]。该反应中使用立体位阻更大的苄基衍生物可以获得更好的区域选择性。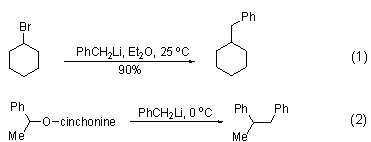
除了普通的对醛、酮化合物的加成反应外,苄基锂试剂还能与乙烯酮发生加成反应,特异性地得到烯醇式结构产物 (式3)[4],进而可用于羟醛缩合反应。苄基锂试剂还可以同环辛四烯的双键发生加成反应,并同时作为碱,得到苄基取代的环辛四烯二阴离子 (式4)[5]。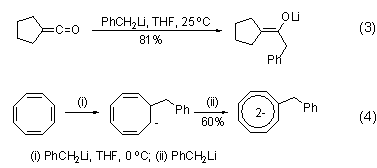
苄基锂试剂对乙烯基底物的加成反应取决于底物双键上的取代基。通常苄基加成到丙烯醇双键取代基较多的碳原子上 (式5)[6],但在铜盐存在下也可以加成到环氧乙烯双键取代基较少的碳上 (式6)[7]。
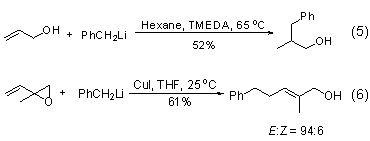
此外,苄基锂试剂也可以在其它金属存在下发生金属交换反应,制备其它金属的苄基化试剂,如苄基锂试剂与一价铜盐反应生成双苄基铜锂试剂[7]。与镍盐反应生成苄基镍试剂[8]。
安全信息
危险运输编码:暂无
危险品标志:暂无
安全标识:暂无
危险标识:暂无
文献
1. Kambe, N.; Sonoda, N. Kagaku to Kogyo. 1992, 66, 38. 2. Korte, W. D.; Cripe, K.; Cooke, R. J. Org. Chem., 1974, 39, 1168. 3. Chodkiewicz, W.; Jore, D.; Wodzki, W. Tetrahedron Lett., 1979, 1069. 4. Haner, R.; Laube, T.; Seebach, D. J. Am. Chem. Soc., 1985, 107, 5396. 5. Miller, J. T.; DeKock, C. W.; Brault, M. A. J. Org. Chem., 1979, 44, 3508. 6. Crandall, J. K.; Clark, A. C. J. Org. Chem., 1972, 37, 4236. 7. Araki, S.; Butsugan, Y. Chem. Lett., 1980, 2, 185. 8. Negishi, E. I.; Bagheri, V.; Chatterjee, S.; Luo, F. T.; Miller, J. A.; Stoll, A. T. Tetrahedron Lett., 1983, 24, 5181. 9.参考书:现代有机bepaly tw <性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号