| 物竞编号 | 1CJL |
|---|---|
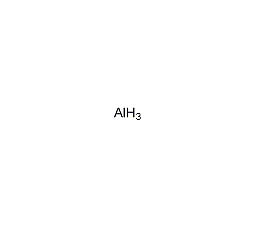
| 分子式 | AlH3 |
| 分子量 | 30.01 |
| 标签 | 铝烷,, Alane |
编号系统
CAS号:7784-21-6
MDL号:暂无
EINECS号:232-053-2
RTECS号:暂无
BRN号:暂无
PubChem号:暂无
物性数据
1.性状:无色固体
2.熔点(oC):110
3.溶解性:溶于THF和乙醚溶剂。
毒理学数据
暂无
生态学数据
暂无
分子结构数据
暂无
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:0
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:1
8.表面电荷:0
9.复杂度:0
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.氢化铝为无色的固体。对热不稳定,加热到150~200℃时即分解。准确的分解温度因AlH3的生成条件而异。氢化铝为强还原剂。遇水或湿气会发生爆炸反应而生成氢气。光照后即分解。在-10℃的封闭管中能够保存一年。极易溶于四氢呋喃中。在乙醚中的溶解度为0.2mol/L。在乙醚中合成的产物是由AlH3和乙醚按摩尔比0.29~0.33构成的加成物。不含乙醚的产物是把AlH3的乙醚溶液加入到特别过量的戊烷或己烷中所得到的白色沉淀。一旦从乙醚中沉淀出来就不会再溶于乙醚中。如果有强的路易斯碱L存在,则生成LAlH3或者L2AlH3而溶解。
2.氢化铝溶液不会自燃,但与水、酸类、潮湿空气接触有引起燃烧危险,遇氧化剂反应剧烈。氢化铝溶液必须原位制备使用,大约3天后就会降解,因此不可能长时间保存。使用是必须小心谨慎。
贮存方法
在氮气中贮存。
合成方法
1. 原料的提纯:以下的所有操作必须在充满氮气或氩气的干燥箱中进行。不得含有水蒸气,含氧量不超过3~4mL/m3。而且,必须在系统中除去能与反应物和生成物进行反应的物质。当存在少量杂质时就可能把生成的氢化铝分解掉。所有的试剂必须全用无水的。市售的乙醚、氢化铝锂、三氯化铝等都必须进一步提纯。使用的玻璃器具要用浓硝酸或者氢氟酸洗过之后,再用蒸馏水冲洗几次,在110~120℃下进行干燥。将氢化铝锂加到乙醚内,在氮气中或真空中蒸馏,并通过装有分子筛的柱(40cm)进行干燥、提纯。因为乙醚非常容易挥发,这些操作应在通风橱内进行。将氢化铝锂溶于乙醚,过滤后经减压蒸馏蒸出溶剂浓缩,进行重结晶。三氯化铝可在高真空下使其升华(110~120℃)得以提纯,在此温度下要使50g三氯化铝升华需要24h,其蒸气再通过1~2cm长的装有活性炭(50~200目)吸附柱处理,可更加纯净。
主反应3LiAlH4+AlCl3→4AlH3+3LiCl
在干燥箱中,把32.3g三氯化铝(0.242mol)和电磁搅拌棒装入500mL圆底烧瓶中,加塞后将烧瓶从干燥箱中取出,在低氮气压下(25~50mmHg,1mmHg=133.322Pa)迅速安装盛有乙醚的滴液漏斗,将上述500mL烧瓶放在干冰二氯甲烷浴中一边搅拌物料一边进行冷却,从滴液漏斗把经过蒸馏提纯的300mL乙醚慢慢地加入烧瓶中。乙醚冷却后从干冰浴中取出烧瓶。如果三氯化铝发生放热的溶剂化反应而使乙醚沸腾时,应把烧瓶再次冷却。三氯化铝溶解后,将溶液加热到室温,严密加塞放入干燥箱。另取28.2g纯氢化铝锂(0.743mol)装入容积为1.5L的烧瓶中,并用750mL蒸馏过的乙醚加以溶解。然后往LiAlH4和AlCl3的乙醚溶液表面分别吹入干燥氮气,使其冷却到-5℃。为了保持一定的溶剂体积必须经常加入乙醚。将AlCl3溶液在搅拌下加到冷的LiAlH4溶液中。加完后,对反应混合液施以19.7~34.2kPa压力的氮气,经玻璃过滤器,滤到1.5L烧瓶中。该烧瓶预先装入10g NaBH4(该NaBH4应在真空中于60℃干燥8h,并粉碎至1μm以下,可得最好的结果)和电磁搅拌棒。搅拌滤液,利用NaBH4将未反应的AlCl3从AlH3的乙醚溶液中除去。LiBlH4留在溶液中,氯化钠则沉淀出来。边往滤液中吹入干燥氮气边搅拌3~4min之后,再往另一个1.5L烧瓶中过滤。这样就可把过剩的NaBH4和已沉淀的氯化钠除去。往滤液中边吹入干燥氮气,边浓缩至600mL之后,加热到室温。经6~8h后,氢化铝的乙醚加成物就沉淀出来。将生成物过滤后,用100mL无水乙醚洗涤两次,在高真空下干燥10~12h;产量约30g(58%)。
用途
1.还原剂,似氢化铝锉。但对卤素、硝基的还原活性比后者小得多,因而选择性更好。还原毅基成轻基。也用于烯胺的氢解,卤代物的脱内、磺酸内酯的脱硫,以及酮厉、院胶和睛还原成胺等。
2.氢化铝是一种对多种官能团有效的还原试剂[1],能够将醛、缩醛、酮、醌、缩酸、酸酐、酰氯、酯和内酯还原为相应的醇,将酰胺、腈、肟和异氰酸酯还原为相应的胺。氢化铝对硝基化合物、硫化物、砜以及甲基苯磺酸盐无还原活性,但是对二硫化物和亚砜有效。
对于酮的还原,氢化铝较其它还原试剂能够表现出不同的立体选择性,这点在具有生物活性的甾族化合物的还原中尤为重要 (式1)[2]。对于α,β-不饱和酮还原为烯丙醇的反应,氢化铝也能表现出特异的立体选择性 (式2)[3]。

对于羧酸和酯的还原反应,氢化铝较氢化铝锂的反应更快。但是对于卤代烷烃的还原,氢化铝则表现出较惰性的还原活性。因此使用氢化铝可以有效地实现带卤素的羧酸和酯的还原反应 (式3)。此外,氢化铝锂能够还原硝基化合物,而氢化铝则对其不具有还原效果,因此使用氢化铝还能实现带硝基的羧酸和酯的还原反应 (式4)。
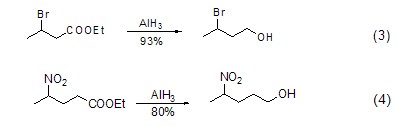
对于酰胺化合物还原为胺的反应,通常存在C-O键断裂和C-N键断裂的竞争反应。但使用氢化铝则可以选择性地实现C-O键的断裂,从而实现α,β-不饱和酰胺向烯丙基胺化合物的转化 (式5)[4]。
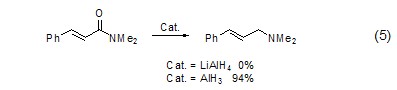
由于氢化铝的碱性相对氢化铝锂较弱,因此对于含酸性氢原子的底物同样适用。如对含有酸性α-H的烯丙基腈化合物的还原 (式6,式7)。
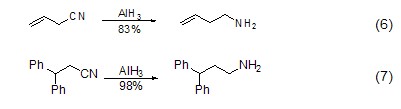
氢化铝的另一类重要反应是诱导环氧化合物的开环反应。对于大多数环氧化合物,负氢进攻都是发生在立体位阻较小的一端 (式8)[5],但由于氢化铝中负氢自身的性质,它也可以进攻立体位阻较大的碳原子 (式9)[6]。
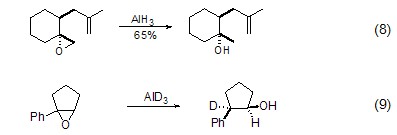
此外,氢化铝还能实现丙炔醇系统上的氢铝化反应,即对炔烃发生加成反应,进而用碘淬灭实现sp2-碘代烯丙醇化合物的制备。并且氢化铝较氢化铝锂表现出了不同的区域选择性,负氢会优先进攻3-位炔碳原子 (式10)[7]。

安全信息
危险运输编码:暂无
危险品标志:暂无
安全标识:暂无
危险标识:暂无
文献
1. (a) Saito, S. Science of Synthesis, 2004, 7, 15. (b) Finholt, A. E.; Bond, A. C.; Schlesinger, H. I. J. Am. Chem. Soc., 1947, 69, 1199. 2. Martinez, E.; Muchowski, J. M.; Velarde, E. J. Org. Chem., 1977, 42, 1087. 3. (a) Brown, H. C.; Hess, H. M. J. Org. Chem., 1969, 34, 2206. (b) Dilling, W. L.; Plepys, R. A. J. Org. Chem., 1970, 35, 2971. 4. Ashby, E. C.; Sanders, J. R.; Claudy, P.; Schwarts, P. J. Am. Chem. Soc., 1973, 95, 6485. 5. Maruoka, K.; Saito, S.; Ooi, T.; Yamamoto, H. Synlett, 1991, 255. 6. Lansbury, P. T.; Scharf, D. J.; Pattison, V. A. J. Org. Chem., 1967, 32, 1748. 7. Elsenbaumer, R. L.; Mosher, H. S.; Morrison, J. D.; Tomaszewskil, J. E. J. Org. Chem., 1981, 46, 4034. 8.参考书:现代有机bepaly tw <性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号