| 物竞编号 | 07QN |
|---|---|
| 分子式 | C8H18SnO |
| 分子量 | 248.94 |
| 标签 | 二正丁基锡氧化物, 二正丁基氧化锡, 氯化二丁基锡, 二丁基氧化锡, 氧化二丁基锡, Dibutyltin(IV) oxide, Dibutyloxotin, (CH3CH2CH2CH2)2SnO, DBTO, 热稳定剂, 抛光海洋防污涂料 |
编号系统
CAS号:818-08-6
MDL号:MFCD00001992
EINECS号:212-449-1
RTECS号:WH7175000
BRN号:4126243
PubChem号:24861710
物性数据
1. 性状:白色到微黄色粉末
2. 密度:1.5 g/cm3
3. 相对蒸汽密度(g/mL,空气=1):未确定
4. 熔点(ºC):>300
5. 沸点(ºC,常压):未确定
6. 沸点(ºC,5.2kPa):未确定
7. 折射率:未确定
8. 闪点(ºC):81-83
9. 比旋光度(º):未确定
10. 自燃点或引燃温度(ºC):未确定
11. 蒸气压(kPa,25ºC):未确定
12. 饱和蒸气压(kPa,60ºC):未确定
13. 燃烧热(KJ/mol):未确定
14. 临界温度(ºC):未确定
15. 临界压力(KPa):未确定
16. 油水(辛醇/水)分配系数的对数值:未确定
17. 爆炸上限(%,V/V):未确定
18. 爆炸下限(%,V/V):未确定
19. 溶解性:溶于大多数有机溶剂,常常在苯、甲苯或者CH3OH溶液中使用。
毒理学数据
急性毒性:大鼠口经LD50:44900ug/kg,大鼠腹腔LD50:40mg/kg
生态学数据
对水是稍微有害的,不要让未稀释或大量的产品接触地下水,水道或者污水系统,若无政府许可,勿将材料排入周围环境。
分子结构数据
暂无
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:1
4.可旋转化学键数量:6
5.互变异构体数量:无
6.拓扑分子极性表面积17.1
7.重原子数量:10
8.表面电荷:0
9.复杂度:81.3
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.常温常压下稳定,避免氧化物接触。
2.具有C-Sn键而具有较高的毒性,建议在通风橱中操作和使用。
贮存方法
保持容器密封,储存在阴凉,干燥的地方。
合成方法
暂无
用途
1. 用于车用和工业用水性聚氨酯电泳漆中。非常有效的酯交换反应的催化剂。用于需做高温酯交换反应的涂料用树脂之生产。 是合成有机锡的中间体之一,应用于PVC热稳定剂、SPC自抛光海洋防污涂料,以及木材防腐、农业杀菌剂、玻璃处理及有机合成等方面。
2. 二正丁基氧化锡 (DBTO) 在有机合成中具有多种用途,但是最具特色的反应来自于它能够与醇反应生成二烷氧基锡中间体。该中间体可以与各种亲核试剂反应衍生出一系列具有重要合成价值的反应。
DBTO非常容易与醇反应生成二烷氧基锡化合物,许多时候与1,2- 或者1,3-二羟基底物定量地生成具有五元环或者六元环结构的二烷氧基锡中间体。它与糖分子底物反应时,可以选择性地生成热力学稳定的环状二烷氧基氧化锡中间体[1,2]。生成的环状二烷氧基氧化锡中间体并没有对二羟基起到保护基的作用,而是对羟基的反应性起到致活的作用。在季铵盐或者CsF的催化下,该中间体可以与卤化物发生反应,选择性地生成单烷基醚的产物[3]。由于该中间体的合成是如此成熟,以至于在绝大多数情况下不对它们进行分离和鉴定就直接用于烷基化反应。当生成中间体的醇羟基不同时,烷基化的选择性优先次序是:伯醇 > 仲醇 > 叔醇 (式1)[4,5]。当烯丙基类型羟基存在时,烷基化总是发生在烯丙基醇羟基上 (式2)[6]。
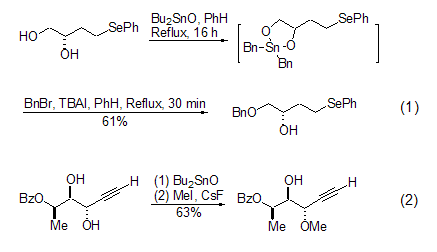
环状二烷氧基氧化锡中间体的高度选择性单酰化反应非常有意义,酸酐或者酰卤都是合适的酰化试剂。对于不同的醇羟基,生成酯的优先次序是:烯丙基醇 > 伯醇 > 仲醇 > 叔醇 (式3)[7,8]。使用磺酰卤则选择性地得到相应的单磺酰酯产物 (式4)[9,10]。
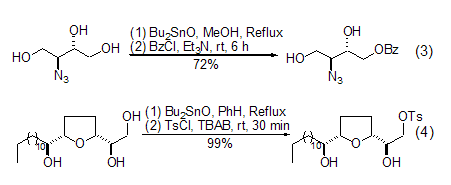
如果直接使用二羟基底物与DBTO生成中间体后再经二酰卤进行酰化,则得到大环内酯产物 (式5)[11,12]。硫醇可以发生类似的反应[13]。
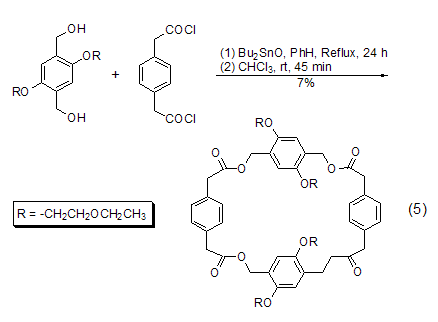
此外,环状二烷氧基氧化锡中间体经NBS选择性氧化生成酮的反应 (式6)[14] 以及DBTO-TMSN3 将腈基转变为四氮唑 (式7)[15]的反应也值得关注。

安全信息
危险运输编码:UN 3146 6.1/PG 2
危险品标志: 有毒
有毒
安全标识:S45 S36/S37/S39
危险标识:R25
文献
1. Wagner, D.; Verheyden, J. P. H.; Moffatt, J. G. J. Org. Chem., 1974, 39, 24. 2. Yamamura, T.; Hada, N.; Kaburaki, A.; Yamano, K.; Takeda, T. Carbohydr. Res., 2004, 339, 2749. 3. Quinn, K. J.; Isaacs, A. K.; Arvary, R. A. Org. Lett., 2004, 6, 4143. 4. Crich, D.; Li, W.; Li, H. J. Am. Chem. Soc., 2004, 126, 15081. 5. Kang, E. J.; Cho, E. J.; Ji, M. K.; Lee, Y. E.; Shin, D. M. et al. J. Org. Chem., 2005, 70, 6321. 6. Koo, B.; McDonald, F. E. Org. Lett., 2005, 7, 3621. 7. Audouard, C.; Fawcett, J.; Griffith, G. A.; Kerouredan, E.; Miah, A.; Percy, J. M.; Yang, H. Org. Lett., 2004, 6, 4269. 8. Rai, A. N.; Basu, A. Org. Lett., 2004, 6, 2861. 9. Cecil, A. R. L.; Hu, Y.; Vicent, M. J.; Duncan, R.; Brown, R. C. D. J. Org. Chem., 2004, 69, 3368. 10. Sun, C.; Bittman, R. J. Org. Chem., 2004, 69, 7694. 11. Campayo, L.; Bueno, J. M.; Navarro, P.; Ochoa, C.; Jimenez-Barbero, J.; Pepe, G.; Samat, A. J. Org. Chem., 1997, 62, 2684. 12. Bartoli, S.; De Nicola, G.; Roelens, S. J. Org. Chem., 2003, 68, 8149. 13. Vujasinovic, I.; Veljkovic, J.; Mlinaric-Majerski, K. J. Org. Chem., 2004, 69, 8550. 14. Bernardi, A.; Arosio, D.; Manzoni, L.; Micheli, F.; Pasquarello, A.; Seneci, P. J. Org. Chem., 2001, 66, 6209. 15. Ek, F.; Manner, S.; Wistrand, L.-G.; Frejd, T. J. Org. Chem., 2004, 69, 1346. 16.参考书:现代有机bepaly tw <性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无





 沪公网安备 31010602001115号
沪公网安备 31010602001115号