| 物竞编号 | 01HT |
|---|---|
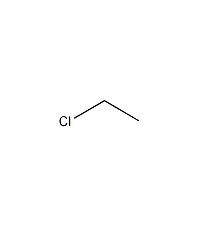
| 分子式 | C2H5Cl |
| 分子量 | 64.51 |
| 标签 | 乙基氯, 氯乙烷, Ethyl chloride, 脂肪族卤代衍生物 |
编号系统
CAS号:75-00-3
MDL号:MFCD00000961
EINECS号:200-830-5
RTECS号:KH7525000
BRN号:1730751
PubChem号:24845449
物性数据
1.性状:无色气体,有类似醚样的气味。[1]
2.熔点(℃):-138.7[2]
3.沸点(℃):12.5[3]
4.相对密度(水=1):0.92[4]
5.相对蒸气密度(空气=1):2.22[5]
6.饱和蒸气压(kPa):133.3(20℃)[6]
7.燃烧热(kJ/mol):-1323.8[7]
8.临界温度(℃):187.2[8]
9.临界压力(MPa):5.23[9]
10.辛醇/水分配系数:1.43[10]
11.闪点(℃):-50(CC)[11]
12.引燃温度(℃):519[12]
13.爆炸上限(%):14.8[13]
14.爆炸下限(%):3.6[14]
15.溶解性:微溶于水,可混溶于多数有机溶剂。[15]
16.黏度(mPa·s,5ºC,液体):0.292
17.闪点(ºC,闭口):-50
18.闪点(ºC,开口):-43
19.蒸发热(KJ/kg,b.p.):383.0
20.熔化热(KJ/kg):69.04
21.生成热(KJ/mol,液体):132.3
22.生成热(KJ/mol,气体):107.6
23.比热容(KJ/(kg·K),0ºC):1.55
24.电导率(S/m,0ºC):<3×10-9
25.热导率(W/(m·K),液体):0.14676
26.体膨胀系数(K-1,0~15ºC,平均):0.00156
27.常温折射率(n20):1.36805
28.常温折射率(n25):1.36625
29.相对密度(25℃,4℃):0.88895
30.偏心因子:0.204
31.Lennard-Jones参数(A):7.198
32.Lennard-Jones参数(K):206.3
33.溶度参数(J·cm-3)0.5:17.731
34.van der Waals面积(cm2·mol-1):5.270×109
35.van der Waals体积(cm3·mol-1):35.520
36.气相标准声称热(焓)( kJ·mol-1) :-112.3
37.气相标准熵(J·mol-1·K-1) :275.89
38.气相标准生成自由能( kJ·mol-1):-60.4
39.气相标准热熔(J·mol-1·K-1):62.64
40.液相标准声称热(焓)( kJ·mol-1):-132.80
41.液相标准熵(J·mol-1·K-1) :190.79
42.液相标准生成自由能( kJ·mol-1):-55.73
43.液相标准热熔(J·mol-1·K-1):108.8
毒理学数据
1.急性毒性[16]
LC50:160000mg/m3(大鼠吸入,2h);146000mg/kg(小鼠吸入)
2.刺激性 暂无资料
3.致突变性[17] 微生物致突变:鼠伤寒沙门菌10μg/皿。哺乳动物体细胞突变:仓鼠卵巢2340mg/L。
4.致癌性[18] IARC致癌性评论:G3,对人及动物致癌性证据不足。
生态学数据
1.生态毒性 暂无资料
2.生物降解性[19]
好氧生物降解(h):168~672
厌氧生物降解(h):672~2688
3.非生物降解性[20]
空气中光氧化半衰期(h):160~1604
一级水解半衰期(h):912
4.其他有害作用[21] 该物质对环境可能有危害,应特别注意对地表水、土壤、大气和饮用水的污染,对水生生物应给予特别注意。
分子结构数据
1、摩尔折射率:16.16
2、摩尔体积(cm3/mol):72.9
3、等张比容(90.2K):150.1
4、表面张力(dyne/cm):17.9
5、极化率(10-24cm3):6.40
计算化学数据
1.疏水参数计算参考值(XlogP):1.2
2.氢键供体数量:0
3.氢键受体数量:0
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:3
8.表面电荷:0
9.复杂度:2.8
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.氯乙烷在无水分存在时,加热至400℃几乎不发生变化。400~500℃部分分解成乙烯和氯化氢。在浮石存在下加热至500~600℃,大部分分解成乙烯和氯化氢。金属、金属氯化物和金属氧化物能加速其分解。在醇碱溶液中,氯乙烷易脱去氯化氢生成乙烯。与水一起在封管中加热至100℃水解成乙醇。在二氧化钛、氯化钡等催化剂存在下,300~425℃与水蒸气反应生成乙醇、乙醛、乙烯。光照下与氯反应生成1,1-二氯乙烷。在五氧化锑存在下,则生成1,2-二氯乙烷。在Fridel-Crafts型催化剂存在下与苯反应生成乙苯。与铅钠合金反应得到四乙基铅。
2.稳定性[22] 稳定
3.禁配物[23] 强氧化剂、钾、钠及其合金
4.聚合危害[24] 不聚合
5.分解产物[25] 氯化氢
贮存方法
储存注意事项[26] 储存于阴凉、通风的易燃气体专用库房。远离火种、热源。库温不宜超过30℃。应与氧化剂、活性金属粉末等分开存放,切忌混储。采用防爆型照明、通风设施。禁止使用易产生火花的机械设备和工具。储区应备有泄漏应急处理设备。
合成方法
工业上生产氯乙烷普遍采用乙烯氢氯化法,少数采用乙烷氯化法,极少数采用乙醇法。
1.乙烯氢氯化法:以乙烯与氯化氢为原料进行加成反应制取。本法技术经济比较合理,有气相法和液相法两种。液相法为在AlCl3等催化剂存在下,用高浓度乙烯在氯乙烷等溶剂中与氯化氢进行反应(30-40℃,253-303kPa),碱洗后进行气液分离,蒸馏得纯品。气相法是以AlCl3、NH4Cl、硅胶等为催化剂,用较低浓度的乙烯乙烷混合气为原料,在130-250℃下反应制取。
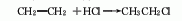
2.乙烷氯化法:工业上以热氯化法为主,即将乙烷在250-500℃、压力202-304kPa下进行氯化反应(副产的氯化氢和乙烯反应,也可制得氯乙烷)。3.乙醇法 由乙醇与盐酸在氯化锌存在下反应。原料消耗定额:乙醇(95%)945kg/t、盐酸(30%)2830kg/t、氯化锌90kg/t。另外,将生产三氯乙醛的副产盐酸吸收后的尾气,用98%硫酸干燥,然后经加压、冷冻、液化、精馏提纯,也可得到氯乙烷。
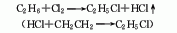
用途
1.主要用作四乙基铅、乙基纤维素及乙基咔唑染料等的原料。也可作烟雾剂、冷冻剂、局部麻醉剂、乙基化剂、烯烃聚合溶剂、汽油抗震剂等。还用作聚丙烯的催化剂,磷、硫、油脂、树脂、蜡等的溶剂;农药、染料、医药及其中间体的合成。
2.用作聚丙烯的催化剂,也用作冷冻剂、麻醉剂、杀虫剂等。[27]
安全信息
危险运输编码:UN1037 2.1
危险品标志: 很易燃
很易燃  有害
有害
文献
[1~27]参考书:危险beplay体育首页 安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无






 沪公网安备 31010602001115号
沪公网安备 31010602001115号