| 物竞编号 | 01HL |
|---|---|
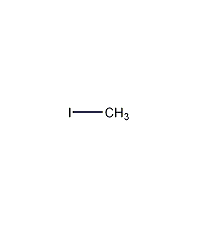
| 分子式 | CH3I |
| 分子量 | 141.94 |
| 标签 | 甲基碘, 一碘甲烷, Methyl iodide, 甲基化试剂, 灭火剂, 卤代烃类溶剂 |
编号系统
CAS号:74-88-4
MDL号:MFCD00001073
EINECS号:200-819-5
RTECS号:PA9450000
BRN号:969135
PubChem号:24857202
物性数据
1.性状:无色透明液体,有特臭。见光变成棕色。[12]
2.熔点(℃):-66.5[13]
3.沸点(℃):42.5[14]
4.相对密度(水=1):2.3[15]
5.相对蒸气密度(空气=1):4.89[16]
6.饱和蒸气压(kPa):50(20℃)[17]
7.燃烧热(kJ/mol):-813.8[18]
8.临界温度(℃):254.8[19]
9.临界压力(MPa):7.36[20]
10.辛醇/水分配系数:1.51~1.69[21]
11.溶解性:微溶于水,溶于乙醇、乙醚。[22]
12.常温折射率(n25):1.5270
13.偏心因子:0.193
14.溶度参数(J·cm-3)0.5:20.172
15.van der Waals面积(cm2·mol-1):4.600×109
16.van der Waals体积(cm3·mol-1):32.850
17.气相标准声称热(焓)( kJ·mol-1) :14.7
18.气相标准熵(J·mol-1·K-1) :253.81
19.气相标准生成自由能( kJ·mol-1):16.4
20.气相标准热熔(J·mol-1·K-1):44.08
21.液相标准声称热(焓)( kJ·mol-1):-12.3
22.液相标准熵(J·mol-1·K-1) :162.8
23.液相标准生成自由能( kJ·mol-1):16.5
24.液相标准热熔(J·mol-1·K-1):82.91
毒理学数据
1.急性毒性[23]
LD50:100~200mg/kg(大鼠经口)
LC50:1300mg/m3(大鼠吸入,4h)
2.刺激性[24] 人经皮:1g(30min),轻度刺激。
3.致突变性[25] 微生物致突变性:鼠伤寒沙门菌2μl/皿;大肠杆菌20μmol/L。哺乳动物体细胞突变性:小鼠淋巴细胞15mg/L(2h)。DNA损伤:大肠杆菌1μmol/L。
4.致癌性[26] IARC致癌性评论:G3,对人及动物致癌性证据不足。
生态学数据
1.生态毒性 暂无资料
2.生物降解性[27]
好氧生物降解(h):168~672
厌氧生物降解(h):672~2688
3.非生物降解性[28]
光解最大光吸收(nm):260
水中光氧化半衰期(h):480~1440
空气中光氧化半衰期(h):535~5348
一级水解半衰期(h):2640
4.其他有害作用[29] 该物质对环境有危害,应注意对大气的污染。
分子结构数据
1、摩尔折射率:19.65
2、摩尔体积(cm3/mol):63.8
3、等张比容(90.2K):145.9
4、表面张力(dyne/cm):27.2
5、极化率(10-24cm3):7.79
计算化学数据
1.疏水参数计算参考值(XlogP):1.5
2.氢键供体数量:0
3.氢键受体数量:0
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:2
8.表面电荷:0
9.复杂度:2
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.碘甲烷具有毒性、腐蚀性并可能导致癌症。储藏时应放置在棕色瓶中,以防止暴露于光中释放出I2,另外储藏温度要低。
2.稳定性[30] 稳定
3.禁配物[31] 强氧化剂、强碱、亚氯酸银、钠、镁、锌等
4.聚合危害[32] 不聚合
5.分解产物[33] 碘化氢
贮存方法
储存注意事项[34] 储存于阴凉、通风良好的专用库房内,实行“双人收发、双人保管”制度。远离火种、热源。保持容器密封。应与氧化剂、碱类、食用beplay体育首页 分开存放,切忌混储。配备相应品种和数量的消防器材。储区应备有泄漏应急处理设备和合适的收容材料。
合成方法
1.由硫酸二甲酯歧化而得:

2.在搅拌下将碘化钾、水和少量碳酸钙混合均匀,加热到60~65℃并保温,然后慢慢滴加理论量的硫酸二甲酯,加完后将温度升至65~70℃,反应的同时蒸出碘甲烷:
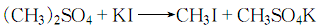
蒸出液静置后分层,弃去水层,油层用无水氯化钙干燥脱水后,加入少许碘化钾颗粒精馏,收集41~43℃馏分,即为成品。
3.在A罐中加入赤磷和甲醇,在A罐中加入碘片,用蒸汽加热A罐,使甲醇沸腾蒸发进入A罐,与碘片接触后流回A罐,如此反复至溶液接近无色。然后蒸出,得粗品碘甲烷。过程中要控制加热速度,使反应不至于太激烈。反应式为:
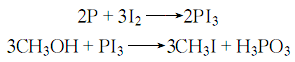
将粗品碘甲烷依次用水、5%碳酸钠和5%硫代硫酸钠各洗涤一次,得无色液体,静置分层,取下层液体用无水氯化钙和少量海波、干碳酸钠密闭避光干燥,然后过滤,即得成品。
用途
1.本品在医药工业用于碘甲基蛋氨酸(维生素u)、镇痛药、解毒药磷敌等药物的生产;在有机合成上作甲基化剂合成碘仿;此外还用作灭火剂等。
2.碘甲烷可以用来进行碳、氧、氮、硫以及三价磷的甲基化。
C-甲基化 碘甲烷是一种活泼的烷基化试剂,可以与酮、酯、羧酸、氨基化合物、氰基化合物、硝基烷烃、砜、亚砜、亚胺以及腙所形成的碳负离子作用,进行甲基化反应。在反应中,碘甲烷的用量变化比较大,有时量较小,有时甚至可以用来作为溶剂使用。
在强碱(如正丁基锂)作用下,于–40 °C低温反应,羰基的α-位碳原子可以甲基化 (式1)[1]。
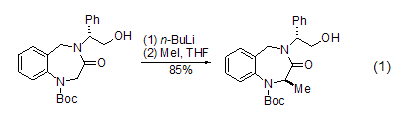
O-甲基化 在DMF溶液中,羧酸在碱如碳酸钾、碳酸氢钾或二异丙基乙基胺[2]存在下与碘甲烷反应来制备相应的甲酯。酚羟基通常也可以在这种条件下甲基化[3],而脂肪醇甲基化通常在非质子极性溶剂中使用较强的碱 (式2)[4]。

S-甲基化 碘甲烷可以使硫醇[5]等硫化物甲基化,得到硫化物和锍盐。比如,在THF中硫代酰胺与碘甲烷作用,可使硫甲基化形成硫醚 (式3)[6]。

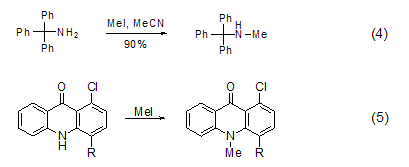
N-甲基化 用碘甲烷对氨和一级胺进行甲基化通常不是一个很好的方法,因为会进一步进行甲基化,但对二级胺和三级胺的甲基化却是较好的方法,可以分别用来制备三级胺和四级铵盐[7]。在乙腈溶剂中,三苯甲基胺用碘甲烷甲基化,可以得到较高产率的产物 (式4)[8]。杂环中的氮原子,也可以用碘甲烷使其甲基化 (式5)[9,10]。
P-甲基化 三配位磷与碘甲烷作用可以生成盐 (式6)[11],通常这样的反应在极性溶剂如乙腈、DMF或THF中进行。

3.用于医药、有机合成、吡啶的检验、显微镜检查等。[35]
安全信息
危险运输编码:UN 2644 6.1/PG 1
危险品标志: 有毒
有毒
文献
1. Cabedo, N.; Pannecoucke, X.; Quirion, J.-C. Eur. J. Org. Chem., 2005, 1590. 2. Tsuyoshi, S.; Mizue, H.; Akio, K. Tetrahedron Lett., 2005, 46, 2659. 3. Srikrishna, A.; Ravikumar, P. C. Tetrahedron Lett., 2005, 46, 6105. 4. Taylor, M. C.; Hardré, R.; Edward, J. B. P. J. Org. Chem., 2005, 70, 1306. 5. Shinichi, I.; Youichi, N.; Takashi, I.; Taeko, H.; Yoshihiro, M.; Shohei, H.; Naoyuki, K.; Yuji, I.; Masanori, B.; Yoshihiro, S. Bioorg. Med. Chem., 2005, 13, 397. 6. Pearson, M. S. M.; Robin, A.; Bourgougnon, N.; Meslin, J. C.; Deniaud, D. J. Org. Chem., 2003, 68, 8583. 7. Amato, J. S.; Chung, J. Y. L.; Cvetovich R. J.; Gong, X.; McLaughlin, M.; Reamer, R. A. J. Org. Chem., 2005, 70, 1930. 8. Theodorou, V.; Ragoussis, V.; Strongilos, A.; Zelepos, E.; Eleftheriou, A.; Dimitriou, M. Tetrahedron Lett., 2005, 46, 1357. 9. Dheyongera, P. J.; Geldenhuys, J. W.; Dekker, G. T.; Van der Schy, J. C. Bioorg. Med. Chem., 2005, 13, 689. 10. Koehler, T.; Ou, Z.; Lee, J. T.; Seidel, D.; Lynch, V.; Kadish, K. M.; Sessler, J. L. Angew. Chem., Int. Ed., 2005, 44, 83. 11. van Alem, K.; Belder, G.; Lodder, G.; Zuilhof, H. J. Org. Chem., 2005, 70, 179. [1~11]参考书:现代有机bepaly tw <性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7 [12~35]参考书:危险beplay体育首页 安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无






 沪公网安备 31010602001115号
沪公网安备 31010602001115号