| 物竞编号 | 000G |
|---|---|
| 分子式 | Na |
| 分子量 | 23 |
| 标签 | 曹打, Natrium, 纯元素, 还原剂, 脱水剂, 冷却剂, 电子高纯单质原料及中间体 |
编号系统
CAS号:7440-23-5
MDL号:MFCD00085307
EINECS号:暂无
RTECS号:VY0686000
BRN号:暂无
PubChem号:24871915
物性数据
1.性状:银白色柔软的轻金属,常温下质软如蜡。[1]
2.熔点(℃):97.8[2]
3.沸点(℃):881.4~892[3]
4.相对密度(水=1):0.97[4]
5.饱和蒸气压(kPa):0.16(440℃)[5]
6.燃烧热(kJ/mol):-209.5[6]
7.临界压力(MPa):34.7[7]
8.辛醇/水分配系数:-0.77[8]
9.引燃温度(℃):>115[9]
10.溶解性:不溶于煤油、乙醚、苯,溶于液氨。[10]
毒理学数据
1.急性毒性[11] LD50:4000mg/kg(小鼠腹腔)
2.刺激性 暂无资料
生态学数据
1.生态毒性 暂无资料
2.生物降解性 暂无资料
3.非生物降解性 暂无资料
4.其他有害作用[12] 该物质对环境有危害,应特别注意对水体的污染。
分子结构数据
1、摩尔折射率:无可用的
2、摩尔体积(cm3/mol):无可用的
3、等张比容(90.2K):无可用的
4、表面张力(dyne/cm):无可用的
5、介电常数:无可用的
6、极化率(10-24cm3):无可用的
7、单一同位素质量:22.98977 Da
8、标称质量:23 Da
9、平均质量:22.9898 Da
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:0
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:1
8.表面电荷:0
9.复杂度:0
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.化学性质极活泼,能与许多有机物及无机物发生反应;与金属或非金属可直接化合,如与铅生成铅钠合金、与汞生成钠汞齐等。在空气中急速氧化。燃烧时呈黄色火焰。与皮肤接触易引起烧伤。 遇醇分解,不溶于醚和苯。常温时为蜡状,易用刀切开。其蒸气带有紫色,高温时呈黄色,有极好的传热性。新切面有光泽,在空气中氧化转变为暗灰色。质软而轻,在-20℃时变硬。遇水剧烈分解,生成氢氧化钠和氢气并产生热量而自燃或爆炸。燃烧时发亮黄色火焰。与卤素和磷直接化合。能还原许多氧化物成元素状态,也能还原金属氯化物。溶于液氨时成蓝色溶液。在氨中加热生成氨基钠。溶于汞生成钠汞齐。
2.稳定性[13] 稳定
3.禁配物[14] 强氧化剂、水、氧、酸类、卤素(氯、氟、溴蒸气)、磷、许多氧化物
4.避免接触的条件[15] 空气、潮湿空气
5.聚合危害[16] 不聚合
贮存方法
储存注意事项[17] 浸于煤油中。储存于阴凉、干燥、通风良好的专用库房内,远离火种、热源。库温不超过32℃,相对湿度不超过75%。包装要求密封,不可与空气接触。应与氧化剂、酸类、卤素等分开存放,切忌混储。采用防爆型照明、通风设施。禁止使用易产生火花的机械设备和工具。储区应备有合适的材料收容泄漏物。
合成方法
1.将含有氯化钠33%、氯化鍶24%、氯化钙28%、氯化钡15%的四元点解质经干燥脱水精制后进行电解。
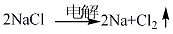
电解温度控制在590-630 ºC,槽电流强度24000A、槽电压605-705V,阴极电流密度0.97A/cm2、阳极电流密度1A/cm2 。阴极收集到的粗钠于120-150 ºC进行熔化、澄清,上层清液即为精制钠。下层残液经蒸馏可回收钠。阴极收集钠需用氮气防护。方法2:经精制后的二元电解质氢氧化钠和碳酸钠进行电解,温度为285-305 ºC,槽电流强度为2500A,槽电压4.5-5V,阳极电流密度0.89A/cm2,阴极电流密度0.94-1.03A/ cm2。阴极手机的粗钠于110-120 ºC精制得成品。
2.用碱金属的叠氮化合物在高真空下加热分解,可以制得很纯的不含气体的碱金属。
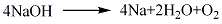
分解叠氮化合物的仪器装置如图I-8所示:
图I-8 由叠氮化物制取碱金属的装置
1--分解反应管;2,3--冷阱;4--汞封活门;5,6--接受器;7,8--烧封处;9--盛装制得的金属用的安瓿
仪器是由在高温下能够耐碱腐蚀的硬质玻璃制成。为防止由于叠氮化合物的分解而引起装置内的压力突然升高,所有导管的直径都应大于12~16mm。将叠氮化合物在玛瑙研钵中研细,装入分解反应管中,约占反应体积的1/4,使其均匀分布,然后将反应管与整个装置熔接在一起,反应管放在电热套中,将盖斯勒(Geisler)放电管真空规与装置妥善连接,两个冷阱均浸入液化空气中。开启前级真空泵将装置抽真空,并加热至200℃,保温12h,若放电管中无放电现象,说明装置中达到并维持良好的真空状。调高电炉的温度使之逐渐升至275℃(叠氮化钠的分解温度),关闭汞封活门4,不致使叠氮化物分解时放出的N2将叠氮化物挟带至接受器5中,与金属钠混杂在一起。一旦分解反应开始,装置内的压力会突然增高,为了减低压力,要调低温度,同时打开联接缓冲容器的阀门(缓冲容器是一个用前级真空泵已抽成真空的8L的圆底烧瓶)。另外还要注意避免叠氮化合物因过热而引起的爆炸性分解,而将装置炸碎。当盖斯勒放电管中放电现象消失时,标志分解反应完成。金属钠由反应管被蒸馏到接受器6中,在联接管7处将反应管1熔封拉下,同时将导管8熔封,隔断前级真空,开启高真空泵,并打开汞封活门4,加热接受器6,使更纯的金属钠进入5。将5中的金属钠熔融,金属钠即流入安瓿9,最后将安瓿的熔封拉下,纯金属钠即在真空安瓿中保存。
3.用锆还原制取金属钠。因为在制备过程中不与气体接触,因此不含反复真空蒸馏也难于去除的气体,可以保证金属钠的纯度。所用原料为碱金属的铬酸盐或重铬酸盐、钼酸盐、钨酸盐与锆粉。Na2MoO4或Na2WO4与Zr粉的质量比为1∶4,将两者的细粉末混合均匀,压成小棒状,放在一根已加热排过气体的石英管中,然后抽到高真空,加热至约550℃(Na2WO4为450℃)A,B—烧瓶生分解反应。得到的金属钠凝附在石英管壁上温度较低的部分。用钼酸钠Na2MoO4作原料时得到的金属钠的产率几乎为理论量。
钠的提纯方法:用真空蒸馏法将金属钠提纯。
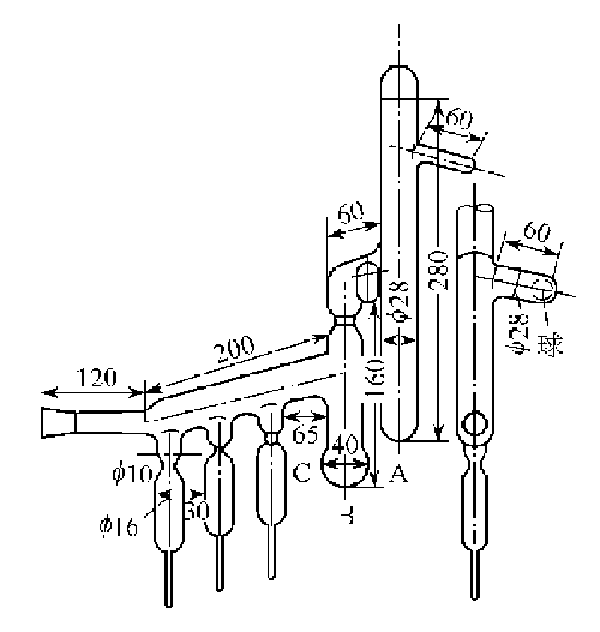
图I-9 钠的蒸馏装置(图中单位为毫米)A,B--烧瓶
将装置抽真空,同时加热1~2h使其干燥,然后充入无氧无水的高纯氩气。在干燥箱中除去金属钠表层的氧化物,截下烧瓶A的顶端将处理好的金属钠装入烧瓶A中,熔封截口。抽真空,将真空度达到10-3~10-4Pa时加热装置,烧瓶A中的金属钠被蒸馏流向B中。烧瓶A中的残留物用球封住。调节温度使烧瓶B中的金属钠被蒸馏逐滴滴入安瓿中。蒸馏完毕,待装置冷却充入氩气,将安瓿熔封切断,金属钠即可在充有氩气的安瓿中保存。
4.方法一:取比需用觉多一点的钠放在厂’口锥形瓶或高烧杯中,用干燥二甲苯复盖。将瓶加热至钠熔融而留下表面氧化物壳皮。移去热源,温和地旋动瓶子使钠生成若干球体。然后将瓶在不太搅动的情况下冷却以免钠球又结在一起。在冷却过程中向溶剂中通入氮气。待钠固化后,用一支尖锐的铁丝或其它器械取出清洁的球休,迅速用滤纸拭干,放在容器中。氧化物壳皮中只含很少的钠,倾去溶剂,用叔了醇处理使之与残留的钠相作用。在装有短的回流冷凝器和强力机械搅拌器的2升两颈烧瓶中,放400毫升干燥二甲苯和29克(1.26克原子)上述方法制得的金属钠球体或小块。把烧瓶放在油浴中加热,使金属钠完全熔融。开动搅拌器使金属钠粉碎成很小的颗粒,移去油浴,但继续搅拌,直到金属钠凝固成很细的颗粒为止。然后倾出二甲苯。方法二:取100毫升园底烧瓶,安装冷凝器,上附一钠石灰干燥管。将2克切去外皮的洁净金属钠切成小片,放入瓶内,并加入无水二甲苯复盖,于油浴内加热近佛腾。移去油浴,迅速将瓶取下,用塞子塞紧,并用双层毛巾或布包裹,用力摇几下,即成细小钠砂。
用途
1.测定有机物中的氯,还原和氢化有机化合物,检验有机物中的氮、硫、氟。去除有机溶剂(苯、烃、醚)中的水分,除去烃中的氧、碘或氢碘酸等杂质。
2.制备钠汞齐、醇化钠、纯氢氧化钠、过氧化钠、氨基钠等。
3.冶金工业用于还原钛、锆等金属氧化物。可用于生产汽油抗震剂四乙基铅。炼油工业用作油品的脱硫剂。无机工业用于制造氰化钠、过氧化钠、氨基钠等。在工业上用作强力还原剂和脱水剂。利用金属钠较好的导电性能,可制造电缆。添加于铝中可增加硬度,用以制造车辆轴承合金。电光源工业用于制造单色光源钠光灯。医药工业用于生产西力生、维生素B1、咖啡因及其他医药产品。也用于合成靛蓝染料和染料中间体,还用作合成橡胶的催化剂。原子能工业用作原子能高速增殖炉的冷却剂。
4.用作分析试剂。制备钠化合物及合金。在工业上用作强力还原剂和脱水剂,合成橡胶的催化剂、石油的脱硫剂。
5.用于制造氰化钠、过氧化钠和多种化学药物,也用作还原剂。[18]
安全信息
危险运输编码:UN 1428 4.3/PG 1
危险品标志: 易燃
易燃  腐蚀
腐蚀
文献
[1~18]参考书:危险beplay体育首页 安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无





 沪公网安备 31010602001115号
沪公网安备 31010602001115号