| 物竞编号 | 0H1M |
|---|---|
| 分子式 | C7H6N4S |
| 分子量 | 178.22 |
| 标签 | TCDI |
编号系统
CAS号:6160-65-2
MDL号:MFCD00005289
EINECS号:228-183-4
RTECS号:暂无
BRN号:609349
PubChem号:24889110
物性数据
1. 性状:淡红色结晶
2. 密度(g/mL,25℃):未确定
3. 相对蒸汽密度(g/mL,空气=1):未确定
4. 熔点(ºC):98-102
5. 沸点(ºC,常压):未确定
6. 沸点(ºC,2.67KPa):未确定
7. 折射率:未确定
8. 闪点(º F):未确定
9. 比旋光度(º):未确定
10. 自燃点或引燃温度(ºC):未确定
11. 蒸气压(20ºC):未确定
12. 饱和蒸气压(kPa,60ºC):未确定
13. 燃烧热(KJ/mol):未确定
14. 临界温度(ºC):未确定
15. 临界压力(KPa):未确定
16. 油水(辛醇/水)分配系数的对数值:未确定
17. 爆炸上限(%,V/V):未确定
18. 爆炸下限(%,V/V):未确定
19. 溶解性:极易溶于水和乙醇。
毒理学数据
暂无
生态学数据
对水少是稍微危害的,不要让未稀释或大量的产品接触地下水、水道或污水系统。若无政府许可,勿将材料排入周围环境。
分子结构数据
1、 摩尔折射率:51.05
2、 摩尔体积(cm3/mol):127.8
3、 等张比容(90.2K):351.5
4、 表面张力(dyne/cm):57.1
5、 极化率(10-24cm3):20.23
计算化学数据
1.疏水参数计算参考值(XlogP):0.7
2.氢键供体数量:0
3.氢键受体数量:3
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积67.7
7.重原子数量:12
8.表面电荷:0
9.复杂度:166
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
对湿气非常敏感,建议在干燥阴凉处储存。
贮存方法
在干性气体下处置,在阴凉干燥处,密封保存。
合成方法
以硫光气和1-(三甲基硅基)咪唑为原料来制备[1]。
用途
1.用于生化合成反应中基团保护及蛋白质肽链的连接。
2.1,1' -硫碳酰二咪唑 (TCDI) 在有机合成中主要被用作硫羰基转移试剂,与具有活性氢的羟基或者氨基反应生成硫羰基衍生物。羟基生成的硫代羧酸酯可以发生去氧反应,邻二羟基生成的硫代碳酸酯可以发生Corey-Winter成烯反应。
TCDI分子中的硫代碳酰基受到咪唑的活化而具有非常高的硫代甲酰化反应活性。该试剂遇到具有活性氢的氨基后,可以释放出咪唑生成新的C-N键。二胺与TCDI发生反应生成环状的硫脲衍生物 (式1,式2)[2,3]。如果底物分子是羟基-氨基化合物,则生成相应的杂环衍生物[4]。因为这些产物中的许多具有重要的生物学活性,或者用作手性衍生物的分离试剂[5,6],所以该反应具有相当重要的合成意义。

TCDI与羟基化合物反应可以方便地生成硫代甲酸酯化合物,与二羟基底物反应则生成环状硫代碳酸酯的衍生物。由于这些化合物的合成均在中性和非常温和的条件下进行,所以对许多其它官能团不产生明显的影响,具有很宽的应用范围。如果将该反应与金属锡氢化物还原剂连续使用,可以完成羟基的去氧反应 (式3)[7]。硫代碳酸酯衍生物的去氧反应具有非常高度的选择性,立体位阻效应可能是主要的影响因素之一 (式4)[8,9]。如果羟基的邻位有苯基硒取代,则直接生成烯烃化合物 (式5)[10]。

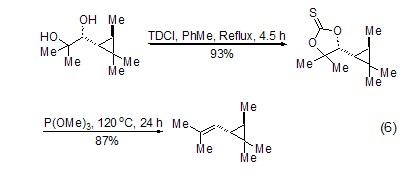
TCDI与邻二羟基底物反应的重要应用是生成的五元环硫代碳酸酯衍生物可以进一步在亚磷酸三甲酯的作用下发生Corey-Winter成烯反应。虽然该反应一般在高温或者亚磷酸三甲酯的沸点温度下完成,但一般都给出非常满意的产率 (式6)[11,12]。
安全信息
危险运输编码:暂无
危险品标志: 刺激
刺激
危险标识:暂无
文献
1. Larsen, C.; Steliou, K.; Harpp, D. N. J. Org. Chem., 1978, 43, 337. 2. Nudelman, A.; Marcovici-Mizrahi, D.; Nudelman, A.; Flint, D.; Wittenbach, V. Tetrahedron, 2004, 60, 1731. 3. Wu, W.-L.; Burnett, D. A.; Spring, R.; Greenlee, W. J.; Smith, M.; Favreau, L.; Fawzi, A.; Zhang, H.; Lachowicz, J. E. J. Med. Chem., 2005, 48, 680. 4. Vanheusden, V.; Munier-Lehmann, H.; Froeyen, M.; Busson, R.; Rozenski, J.; Herdewijn, P.; Van Calenbergh, S. J. Med. Chem., 2004, 47, 6187. 5. Ooi, T.; Kameda, M.; Taniguchi, M.; Maruoka, K. J. Am. Chem. Soc., 2004, 126, 9685. 6. Yoshikawa, N.; Shibasaki, M. Tetrahedron, 2002, 58, 8289. 7. White, J. D.; Wang, G.; Quaranta, L. Org. Lett., 2003, 5, 4109. 8. Lautens, M.; Colucci, J. T.; Hiebert, S.; Smith, N. D.; Bouchain, G. Org. Lett., 2002, 4, 1879 9. Munro, T. A.; Rizzacasa, M. A.; Roth, B. L.; Toth, B. A.; Yan, F. J. Med. Chem., 2005, 48, 345. 10. Kuethe, J. T.; Comins, D. L. J. Org. Chem., 2004, 69, 5219. 11. Krief, A.; Jeanmart, S. Tetrahedron Lett., 2002, 43, 6167. 12. Yamazaki, N.; Kibayashi, C. J. Am. Chem. Soc., 1989, 111, 1396. 13.参考书:现代有机bepaly tw <性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号