| 物竞编号 | 067S |
|---|---|
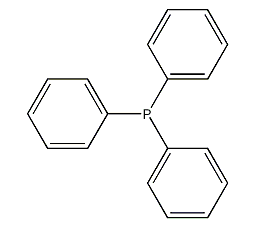
| 分子式 | C18H15O3P |
| 分子量 | 262 |
| 标签 | 暂无 |
编号系统
CAS号:603-35-0
MDL号:MFCD00003043
EINECS号:210-036-0
RTECS号:SZ3500000
BRN号:610776
PubChem号:暂无
物性数据
1.性状:白色结晶[15]
2.熔点(℃):80.5[16]
3.沸点(ºC):377[17]
4.相对密度(水=1):1.194(25ºC)[18]
5.相对蒸气密度(空气=1):9.0[19]
6.临界压力(MPa):7.84[20]
7.辛醇/水分配系数:5.69[21]
8.闪点(ºC):180(OC)[22]
9.溶解性:不溶于水,微溶于乙醇,溶于苯、丙酮、四氯化碳,易溶于乙醚。[23]
毒理学数据
1.急性毒性[24]
LD50:700mg/kg(大鼠经口)
LC50:12167mg/m3(大鼠吸入,4h)
2.刺激性[25]
家兔经皮:500mg(24h),轻度刺激。
家兔经眼:500mg(24h),轻度刺激。
生态学数据
1.生态毒性 暂无资料
2.生物降解性 暂无资料
3.非生物降解性 暂无资料
分子结构数据
1、摩尔折射率:无可用的
2、摩尔体积(cm3/mol):无可用的
3、等张比容(90.2K):无可用的
4、表面张力(dyne/cm):无可用的
5、介电常数:无可用的
6、极化率(10-24cm3):无可用的
7、单一同位素质量:262.091136 Da
8、标称质量:262 Da
9、平均质量:262.2855 Da
计算化学数据
1.疏水参数计算参考值(XlogP):4.6
2.氢键供体数量:0
3.氢键受体数量:0
4.可旋转化学键数量:3
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:19
8.表面电荷:0
9.复杂度:202
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.在剧烈暴晒下会刺激人体,如果长时间接触有神经毒性,属于危险物品,不能与强氧化性试剂共存。芳基膦与氧的反应活性比苄基和烷基膦低。但是空气对于三苯基膦的氧化非常明显,生成了三苯基膦氧化物。三苯基膦不易着火和爆炸,但是当它加热分解时,会生成有毒的磷化氢和POx烟雾。操作时应在通风橱中进行。
2.稳定性[26] 稳定
3.禁配物[27] 强氧化剂
4.避免接触的条件[28] 受热
5.聚合危害[29] 不聚合
6.分解产物[30] 磷烷
贮存方法
储存注意事项[31] 储存于阴凉、通风的库房。远离火种、热源。包装密封。应与氧化剂、食用beplay体育首页 分开存放,切忌混储。配备相应品种和数量的消防器材。储区应备有合适的材料收容泄漏物。
合成方法
在干操的情性气体下,用34.1克(0.22摩尔》嗅代苯,5.2克(0.21克原子)镁及108毫升无水乙醚制得格氏试剂。将所得之苯基溴化镁保存在惰性气体下,搅拌并用冰浴冷却,缓缓加入(15一20分钟)6.0克(0 .044摩尔)三氯化磷和35毫升乙醚溶液。用11毫升浓盐酸和30毫升水的溶液漫慢地处理此混合物。分出乙醚层,水层用乙醚萃取。乙醚溶液合并后,.在常压的氢气下蒸馏,直至蒸馏容器内残留物的温度达285℃残渣用乙醇重结晶二次,得白色三苯嶙8.7克(76%},熔点79.5℃。
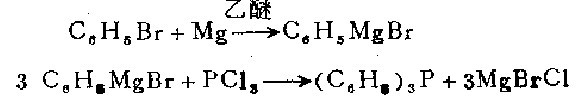
用途
1.用于有机合成,聚合引发剂,抗菌素类药物氯洁霉素的原料,有机微量分析测定磷的标准样品。
2.制钯、铱,铑,镍等络合物催化剂,Wfttig试剂,三苯膦二卤化物脱氧(N-氧化吡啶,亚硝基苯,氢过氧化物),脱硫,脱溴试剂。使a一溴代硝基化合物生成腈。与脂肪重氮化合物反应合成a_酮醛、β一酮酸脂。Beckmann重排。吡啶铃盐的脱季铵化。与溴碘、四氯(溴)化碳,N一溴化丁二烯亚胺等共用于一些合成。
3.三苯基膦是一种相当常用的还原剂,在大多数情况下,反应都是由生成三苯基膦氧化物 (一个热力学有利的反应) 驱动的。另外,三苯基膦广泛用作金属催化剂的配体。
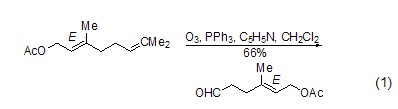
脱氧反应 三苯基膦广泛地应用于过氧化氢或内过氧化物的还原中,反应与底物有关,可生成醇、羰基化合物或环氧化物。这类反应的主要驱动力是三苯基膦与相对较弱的O-O键 (188~209 kJ/mol) 能形成较强的P=O键。例如,利用三苯基膦可以还原分解臭氧化物、选择性制备酮和醛 (式1)[1]。
与叠氮化物的反应 三苯基膦与有机叠氮化合物反应生成亚氨基膦烷 (式2)[2]。
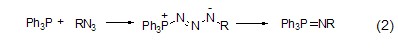
亚氨基膦烷是一种较活泼的亲核试剂,易与亲电试剂反应。如与醛和酮反应生成亚胺和三苯基膦氧化物。这个反应与Wittig反应相似,称作aza-Wittig反应,这个反应的驱动力也是由于三苯基氧膦的生成 (式3)[3]。
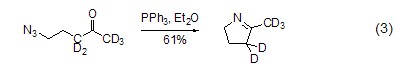
与有机硫化物的反应 室温下三苯基膦可以使环硫化合物转化为烯烃 (式4)[4]。

脱卤反应 α-溴代酮与三苯基膦反应生成酮 (式5)[5]。
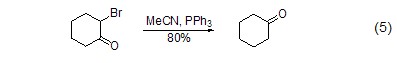
与有机环氧化物的反应 在水和丙酮溶剂中回流,三苯基膦可以使环氧化合物在叠氮化钠参与下转化为环亚胺 (式6)[6]。
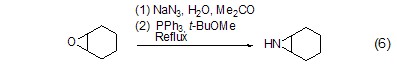
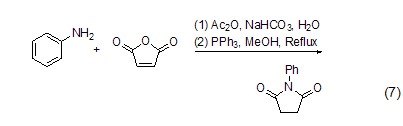
取代吡咯的制备 苯胺、呋喃二酮与三苯基膦反应生成1-苯基-2,5-吡咯二酮 (式7)[7]。
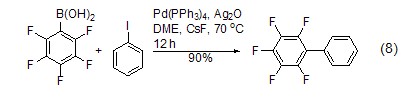
作金属催化剂的配体 它作为配体与许多过渡金属组成金属催化剂,如Pd(PPh3)4就是一种重要的催化剂[8],常用于催化偶联反应的进行,是构建碳-碳键的一种重要方法,其特点是催化条件温和。例如,在Pd(PPh3)4和Ag2O的共同作用下,苯硼酸与芳香卤代烃直接反应生成联苯类化合物,该反应的产率达到了90% (式8)[9,10]。除了苯硼酸和卤代物以外,镁试剂[11]、锌试剂[12]、锡试剂[13]、硅化合物[14]等均可作为偶联反应的底物。
4.广泛用于医药、石化、涂料、橡胶等行业,用作催化剂、促进剂、阻燃剂,也用作分析试剂。[32]
安全信息
危险运输编码:暂无
危险品标志: 有害
有害
文献
1. Trost, B. M.; Machacek, M. R.; Tsui, H. C. J. Am. Chem. Soc., 2005, 127, 7014. 2. Gololobov, Y. G.; Zhmurova, I. N.; Kasukhin, L. F. Tetrahedron, 1981, 37, 437. 3. Jean-Louis, C.; Jean-Pierre, F.; Claudine, F.; Paul, T. Org. Bioorg. Chem., 2003, 1, 1591. 4. Josemon, J.; James, H. E. Chem. Commun., 1999, 1003. 5. Naoshi, K.; Hiroshi, T.; Yasutaka, I. Chem. Lett., 1992, 293. 6. Dalili, S.; Yudin, A. K. Org. Lett., 2005, 7, 1161. 7. Pal, B.; Pradhan, P. K.; Jaisankar, P.; Giri, V. S. Synthesis, 2003, 10, 1549. 8. 综述文献见:(a) Suzuki, A. J. Org. Chem., 1999, 64, 147. (b) Jwanro, H.; Marc, S.; Christel, G.; Emmanuelle, S.; Marc, L. Chem. Rev., 2002, 102, 1359. 9. Korenaga, T.; Kosaki, T.; Fukumura, R.; Ema, T.; Sakai, T. Org. Lett., 2005, 7, 4915. 10. Flaherty, A.; Trunkfield, A.; Barton, W. Org. Lett., 2005, 7, 4975. 11. Uemura, M.; Takayama, Y.; Sato, F. Org. Lett., 2004, 6, 5001. 12. Pei, J.; Ni, J.; Zhou, X.-H.; Cao, X.-Y.; Lai, Y.-H. J. Org. Chem., 2002, 67, 4924. 13. Shirakawa, E.; Yoshida, H.; Nakao, Y.; Hiyama, T. J. Am. Chem. Soc., 1999, 121, 4290. 14. Mowery, M. E.; DeShong, P. J. Org. Chem., 1999, 64, 1684. [1~14]参考书:现代有机bepaly tw <性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7 [15~32]参考书:危险beplay体育首页 安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无










 沪公网安备 31010602001115号
沪公网安备 31010602001115号