| 物竞编号 | 0W6U |
|---|---|
| 分子式 | C6H11NSSi |
| 分子量 | 157.31 |
| 标签 | 三甲硅基-2-噻唑, 2-(三甲基硅基)噻唑, TST, TMST, 2-Trimethylsilanyl-thiazole, 2-(Trimethylsilyl)-1,3-thiazole, 2-(Trimethylsilyl)thiazole, 2-Tst, 2-Thiazolytrimethylsilane, 2-Thiazolyltrimethylsilane, Thiazole, 2-(trimethylsilyl)-, 2-(trimethyl)thiazole |
编号系统
CAS号:79265-30-8
MDL号:MFCD00066274
EINECS号:3538017
RTECS号:暂无
BRN号:暂无
PubChem号:24889725
物性数据
1. 性状:无色液体
2. 密度(g/mL,25/4℃):0.985
3. 相对蒸汽密度(g/mL,空气=1):未确定
4. 熔点(ºC):未确定
5. 沸点(ºC,常压):未确定
6. 沸点(ºC,5.2kPa):56-57
7. 折射率:1.497
8. 闪点(ºC):57
9. 比旋光度(º):未确定
10. 自燃点或引燃温度(ºC):未确定
11. 蒸气压(kPa,25ºC):未确定
12. 饱和蒸气压(kPa,60ºC):未确定
13. 燃烧热(KJ/mol):未确定
14. 临界温度(ºC):未确定
15. 临界压力(KPa):未确定
16. 油水(辛醇/水)分配系数的对数值:未确定
17. 爆炸上限(%,V/V):未确定
18. 爆炸下限(%,V/V):未确定
19. 溶解性:能够溶于大多数有机溶剂,通常在醚类溶剂中使用,例如THF。
毒理学数据
暂无
生态学数据
对水稍微有危害的,不要让未稀释或者大量产品接触地下水,水道或者污水系统。若无政府许可,勿将材料排入周围环境。
分子结构数据
1、 摩尔折射率:45.33
2、 摩尔体积(cm3/mol):157.7
3、 等张比容(90.2K):364.2
4、 表面张力(dyne/cm):28.4
5、 介电常数:
6、 偶极距(10-24cm3):
7、 极化率:17.97
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:2
4.可旋转化学键数量:1
5.互变异构体数量:无
6.拓扑分子极性表面积41.1
7.重原子数量:9
8.表面电荷:0
9.复杂度:99.7
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.远离氧化物。
2.对空气和湿气相对比较稳定。
贮存方法
存放在密封容器内,并放在阴凉,干燥处。储存的地方必须远离氧化剂。
合成方法
通过噻唑在2-位锂化后与Me3SiCl反应来制备[1]。
用途
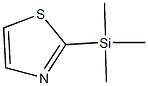
2-(三甲基硅在)噻唑 (TST) (式1)[1] 在现代有机合成中被用作一个典型的噻唑合成子,比传统噻唑金属试剂的反应条件简单,而且对多官能团取代的底物具有高度的化学选择性。TST分子中2-噻唑基作为一个亲核基团可以与1,3-丙二烯、醛、酮和酰氯发生亲核反应生成噻唑取代的产物。

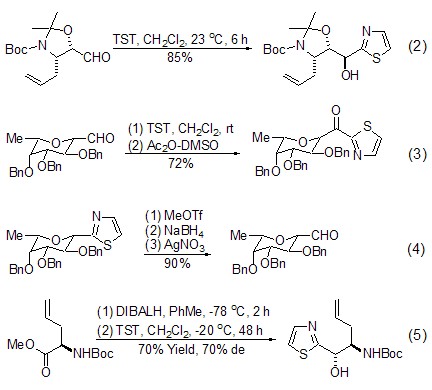
TST与醛[1~5] 和酮[6,7] 发生亲核加成生成α-羟基噻唑产物的反应可以在非常方便的条件下进行,与醛的反应已经得到了非常广泛的应用。该反应通常以CH2Cl2为溶剂,在室温下搅拌数分钟至数小时即可获得满意的收率 (式2,式3)[3,4]。在此条件下,带有多官能团或者不稳定官能团的底物也能够保持高度的化学选择性。如果接着将噻唑基转化为醛基,则得到α-羟基醛的衍生物 (式4)[4]。将酯用DIBALH还原之后直接与TST反应,可以在“一锅煮”条件下得到α-羟基 噻唑衍生物 (式5)[5]。
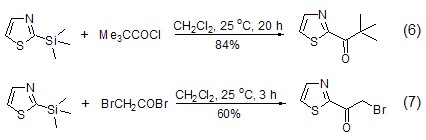
TST与酰氯[1,8~10] 得到α-羰基噻唑的反应也非常温和,虽然苯和环己烷均可以用作反应的溶剂,但是使用CH2Cl2最方便。产物的产率主要受到酰氯结构的影响,α-位拉电子基的存在会降低产物的产率。但是α-位的位阻似乎没有明显的影响,例如:2,2-二甲基丙酰氯可以给出满意的产率 (式6,式7)[1,9]。
安全信息
危险运输编码:UN1993 3/PG 3
危险品标志: 刺激
刺激
危险标识:R36/37/38
文献
1. Dondoni, A.; Fantin, G.; Fogagnolo, M.; Medici, A.; Pedrini, P. J. Org. Chem., 1988, 53, 1748. 2. Alcaide, B.; Almendros, P.; Redondo, M. C. Org. Lett., 2004, 6, 1765. 3. Ghosh, A. K.; Bischoff, A.; Cappiello, J. Org. Lett., 2001, 3, 2677. 4. Dondoni, A.; Catozzi, Nicola; Marra, A. J. Org. Chem., 2004, 69, 5023. 5. Busscher, G. F.; Rutjes, F. P. J. T.; Delft, F. L. Tetrahedron Lett., 2004, 45, 3629. 6. Csuk, R.; Schaade, M. Tetrahedron, 1994, 50, 3333. 7. Dondoni, A.; Boscarato, A.; Formaglio, P.; Begue, J.-P.; Benayoud, F. Synthesis, 1995, 654. 8. Fuerstner, A.; Ernst, A. Tetrahedron, 1995, 51, 773. 9. Alessandro, D.; Alberto, M.; Pedro, M. J. Am. Chem. Soc., 1994, 116, 3324. 10. Fantin, G.; Fogagnolo, M.; Medici, A.; Pedrini, P.; Poli, S. Tetrahedron: Asymmetry, 1992, 3, 107. 11.参考书:现代有机bepaly tw <性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号