| 物竞编号 | 03XA |
|---|---|
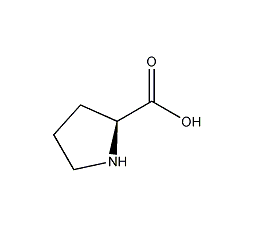
| 分子式 | C5H9NO2 |
| 分子量 | 115.13 |
| 标签 | L-吡咯烷-2-羧酸, 氢化吡咯甲酸, 2-吡咯烷羧酸, (S)-(-)-脯氨酸, (S)-(-)-Proline, 2-Pyrrolidinecarboxylic acid, 氨基酸类药, 中间体, 生化试剂 |
编号系统
CAS号:147-85-3
MDL号:MFCD00064318
EINECS号:205-702-2
RTECS号:TW3584000
BRN号:80810
PubChem号:24898097
物性数据
1. 性状:无色结晶
2. 密度(g/mL,20℃):1.186
3. 熔点(ºC):221
4. 比旋光度(º):-85º
5. 溶解性:易溶于水和乙醇,不溶于丁醇及乙醚。
毒理学数据
暂无
生态学数据
该物质对环境可能有危害,对水体应给予特别注意。
分子结构数据
1、 摩尔折射率:27.90
2、 摩尔体积(cm3/mol):96.9
3、 等张比容(90.2K):249.0
4、 表面张力(dyne/cm):43.4
5、 极化率(10-24cm3):11.06
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:2
3.氢键受体数量:3
4.可旋转化学键数量:1
5.互变异构体数量:无
6.拓扑分子极性表面积49.3
7.重原子数量:8
8.表面电荷:0
9.复杂度:103
10.同位素原子数量:0
11.确定原子立构中心数量:1
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1. 常温常压下稳定。
2. 禁配物:强氧化剂。
3. 存在于烟叶、烟气中。
贮存方法
冷冻干燥保存。
合成方法
1. 明胶、干酪素之类蛋白质的水解物,用离子交换树脂处理,再用苦味酸或雷因克特盐(Reineckeatesalt)处理中性氨基酸部分,仅使L-脯氨酸沉淀,最后用无水乙醇加异丙醇重结晶而得。
由嗜乙酰乙酸棒杆菌(Corynebacteriumacetoacidophilum)XQ-3(由无锡轻工大学中央研究所选育)以氯化铵为氮源经发酵而得。产酸率约60g/L。
2. L-脯氨酸有两种制法。 一是直接发酵法, 利用葡萄糖和黄色短杆菌变异株或谷氨酸棒杆菌野生株,经微生物发酵获得L-脯氨酸; 二是化学合成法,以谷氨酸为原料, 与无水乙醇在硫酸催化下发生酯化, 并加入三乙醇胺将氨基硫酸盐游离出来,得谷氨酸-δ-乙酯。 再用金属还原剂硼氢化钾还原谷氨酸-δ-乙酯,得脯氨酸粗品, 最后对其分离纯化可得粗制脯氨酸。
小试工艺
酯化 称取L-谷氨酸147g, 投入三颈瓶中, 加入无水乙醇1L, 搅拌冷却至0℃, 再滴加H2SO4 80ml, 于0-5℃搅拌反应1h, 室温继续反应1h, 反应全部变清。 在20℃下滴加三乙胺至pH为8-8.5, 析出白色结晶,在室温下再搅拌1h, 静置冷却5℃过滤, 取结晶, 用95%乙醇洗涤, 抽干后真空干燥,得谷氨酸-δ-乙酯约141g。熔点178-180℃, 收率80%-83%。 [α]32D+29.8 (C=1g/ml 10% HCl)。
还原 在三颈瓶中投入谷氨酸-δ-乙酯175g, 加入蒸馏水875ml, 搅拌冷却至5℃, 再分次加入KBH4 53.9g, 约1h加完, 室温再反应1h, 保温50℃反应3h。冷却至0℃, 加入6mol/L HCl调至pH4, 过滤取滤液, 即得粗品L-脯氨酸水溶液。
分离纯化
离子交换树脂-氧化铝柱色谱分离法 将粗品L-脯氨酸水溶液,以4ml/min的流速进入装入732-H+型树脂交换柱中(1g 酸投料需10ml树脂)。 先用蒸馏水冲洗至中性,再用1mol/L氨水洗脱, 收集含L-脯氨酸段的洗脱液(用硅胶G薄层色谱控制)。 将洗脱液减压浓缩至干, 再用少量水溶解后,将其进入中性氧化铝色谱柱中,再以60%乙醇水溶液洗脱(还是用硅胶G薄层色谱控制)。 收集的洗脱液减压浓缩至干,再以无水乙醇洗涤数次, 稍冷后再加入无水乙醚,冷却过滤取结晶, 真空干燥, 得L-脯氨酸。熔点220-222℃(分解),收率28%左右。 [α]24D-82.4 (C=1g/ml, H2O)。
五氯酚沉淀解吸分离法
成盐 将粗品制脯氨酸水溶液置于反应瓶中, 加热至50℃时滴加五氯酚乙醇溶液 (0.111mol/70ml乙醇), 并保温搅拌5h后, 让冷却至0℃, 过滤取结晶, 用少量冰水洗涤, 抽干, 干燥后得复盐,熔点240-242℃, 沉淀率95%。
解析 将复盐38.4g, 投入三颈瓶中, 加入蒸馏水200ml, 氨水20ml, 室温搅拌8h, 冷却至0℃后过滤取滤液,将滤液减压浓缩, 加入蒸馏水100ml, 过滤取滤液, 加入活性炭脱色。乙醚提取, 分出水层, 继续浓缩至干, 用无水乙醇脱色数次, 再加少量无水乙醇湿润, 加入2倍量无水乙醚, 冷却结晶,过滤取结晶, 真空干燥, 得L-脯氨酸成品。
放大生产工艺
酯化 将L-谷氨酸15kg, 无水乙醇100L投入200L反应罐中, 冷却至0℃,搅拌条件下滴加浓H2SO4 8.1L, 保持0℃, 搅拌反应1h, 再保温25℃搅拌反应1h后,加入三乙胺使pH为8.0-8.5。 搅拌1h, 出现白色沉淀。 冷却至5℃, 过滤取沉淀, 用50L95%乙醇洗涤, 沉淀于50℃真空干燥, 得L-谷氨酸-δ-乙酯。
还原 将所得L-谷氨酸-δ-乙酯投入100L反应罐中, 加水70L, 搅拌冷却至5℃, 于1h内分次加完4.3kg KBH4, 加热保温200℃, 搅拌反应1h, 再升温50℃, 搅拌反应3-4h, 冷却至0℃, 以6mol/L的HCl调pH至4.0, 过滤取滤液得L-脯氨酸粗品溶液。
沉淀 将L-脯氨酸粗品溶液投入100L反应罐中,加热至50℃, 在不断搅拌下缓缓加入7L 1.5mol/L的五氯酚乙醇溶液,保温50℃反应5h后, 冷却至0℃析出结晶, 过滤取结晶, 抽干, 得复盐。
解析、精制 将复盐投入100L反应罐内, 加入3%氨水20L, 室温搅拌反应7-8h后, 降温至0℃过滤,沉淀用少量冰水洗涤, 抽干, 洗液和滤液合并, 再减压浓缩至干, 用10L去离子水搅拌溶解,过滤取滤液, 并加入0.5%活性炭, 加热70℃搅拌脱色1h, 过滤取滤液, 让其冷却至0℃, 加等体积乙醚萃取, 分出水层, 减压浓缩至干,加10L无水乙醇脱水3次, 抽干, 沉淀加2L无水乙醇搅匀,再加10L乙醚,冷却至0℃, 过滤取沉淀, 真空抽乙醚, 80℃烘干, 得L-脯氨酸成品。
3. 以明胶为原料用酸水解后经离子交换树脂柱层析而得。
4. 烟草:BU,22;FC,21。
用途
1. 用于生化研究,医药上用于营养不良、蛋白质缺乏症、肠胃疾病、烫伤及术后蛋白质的补充等。
2. 营养增补剂。风味剂,与糖共热发生氨基-羰基反应,可生成特殊的香味物质。按我国GB 2760-86规定可用作香料。
3. 用于氨基酸注射剂、复合氨基酸输液、食品添加剂、营养增补液等。
4. 医药原料及食品添加剂。
5. 脯氨酸本身具有手性,因此在一些天然产物的全合成中,常用作手性先导试剂;同时,作为一种具有光学活性的辅助剂,脯氨酸在不对称全合成中发挥着重要的作用[1]。
不对称催化 在以脯氨酸为手性催化剂时,羰基化合物可以发生不对称Michael反应,产物为β-羟基醛(或酮) (式1)[2~4]。
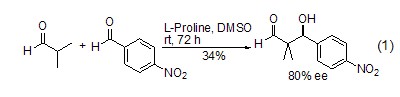
在L-脯氨酸催化下,亚硝基化合物可与羰基化合物发生α-胺氧化反应 (式2)[5,6]。
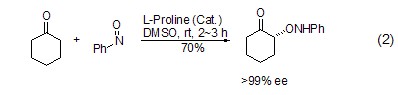
L-脯氨酸同样可以催化不对称Diels-Alder反应 (式3)[7]。
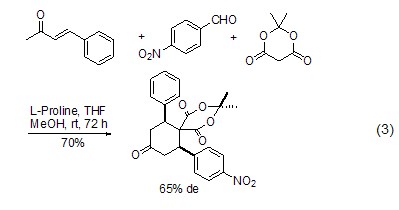
此外,作为不对称合成的手性催化剂,L-脯氨酸还可催化Aldol[8~10]、α-氨基化[11,12]、α-烷基化[13]等反应。
催化碳-碳和碳-氮的合成 除了可以作为手性催化剂催化不对称合成,脯氨酸还可以作为铜的配体,催化碳-碳键 (式4)[14]、碳-氮键 (式5)[15]的形成。

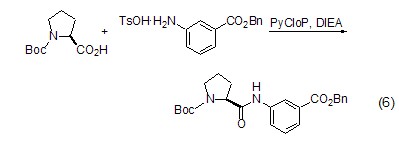
肽键的形成 L-脯氨酸与其它氨基酸类似,同样可以形成肽键 (式6)[16],并且由于L-脯氨酸分子中氨基与羧基处于顺式结构,有利于环肽的形成。
安全信息
危险运输编码:暂无
危险品标志: 易燃
易燃
危险标识:暂无
文献
1. L-Proline 催化不对称合成反应综述见:List, B. Tetrahedron, 2002, 58, 5573. 2. Mase, N.; Tanaka, F.; Barbas III, C. F. Angew. Chem., Int. Ed., 2004, 43, 2420. 3. Fonseca, M. T. H.; List, B. Angew. Chem., Int. Ed., 2004, 43, 3958. 4. List, B.; Pojarliev, P.; Martin, H. J. Org. Lett., 2001, 3, 2423. 5. Bøgevig, A.; Sundén, H.; Córdova, A. Angew. Chem., Int. Ed., 2004, 43, 1109. 6. Hayashi, Y.; Yamaguchi, J.; Sumiya, T.; Shoji, M. Angew. Chem., Int. Ed., 2004, 43, 1112. 7. Ramachary, D. B.; Chowdari, N. S.; Barbas III, C. F. Angew. Chem., Int. Ed., 2003, 42, 4233. 8. List, B.; Pojarliev, P.; Martin, H. J. Org. Lett., 2001, 3, 2423. 9. Northrup. A. B.; Mangion, I. K.; Hettche, F.; MacMillan, D. W. C. Angew. Chem., Int. Ed., 2004, 43, 2152. 10. List, B.; Lerner, R. A.; Barbas, C. F. J. Am. Chem. Soc., 2000, 122, 2395. 11. Kumaragurubaran, N.; Juhi, K.; Zhuang, W,; Bøgevig, A.; Jørgensen, K. A. J. Am. Chem. Soc., 2002, 124, 6254. 12. Chowdari, N. S.; Ramachary, D. B.; Barbas III, C. F. Org. Lett., 2003, 5, 1685. 13. Vignola, N.; List, B. J. Am. Chem. Soc., 2004, 126, 450. 14. Xie, X.; Cai, G.; Ma, D. Org. Lett., 2005, 7, 4693. 15. Zhang, H.; Cai, Q.; Ma, D. J. Org. Chem., 2005, 70, 5164. 16. Kubik, S.; Goddard, R. J. Org. Chem., 1999, 64, 9475. 17.参考书:现代有机bepaly tw <性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7 18. Noguchi M, Satoh Y, Nishida K, et al. Agric. Biol. Chem., 1971, 35: 65-70. 19. Sason M, Matsuyama S. Nippon Sembai Kosha Chuo Kenkyusho Kenkyu Hokoku, 1978, 120: 1-6. 20. Smith Jr W T, Haidar N F, Patterson J M. Tob. Sci, 1975, 142-144.
备注
暂无







 沪公网安备 31010602001115号
沪公网安备 31010602001115号