| 物竞编号 | 0WCT |
|---|---|
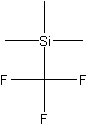
| 分子式 | C4H9F3Si |
| 分子量 | 142.19 |
| 标签 | (三氟甲基)三甲基硅烷, Ruppert’s Reagent, TFMTMS,TMSCF3,TMFTMS,Trimethyl(trifluoromethy)silane, (Trifluoromethyl)trimethylsilane |
编号系统
CAS号:81290-20-2
MDL号:MFCD00145454
EINECS号:暂无
RTECS号:暂无
BRN号:4241868
PubChem号:24872418
物性数据
1. 性状:液体
2. 密度(g/mL25 ºC):0.910
3. 相对蒸汽密度(g/mL,空气=1):未确定
4. 熔点(ºC):未确定
5. 沸点(ºC, 1.013 hPa):54-55
6. 沸点(ºC50mmHg):未确定
7. 折射率:n20/D 1.386
8. 闪点(ºC):-17
9. 比旋光度(º):未确定
10. 自燃点或引燃温度(ºC):未确定
11. 蒸气压(kPa,):10.98(55℃)
12. 饱和蒸气压(kPa,60ºC):未确定
13. 燃烧热(KJ/mol):未确定
14. 临界温度(ºC):未确定
15. 临界压力(KPa):未确定
16. 油水(正辛醇/水)分配系数的对数值:未确定
17. 爆炸上限(%,V/V):未确定
18. 爆炸下限(%,V/V):未确定
19. 溶解性:溶于大多数有机溶剂。
毒理学数据
生态学数据
总括注解
水危害级别1(德国规例)(通过名单进行自我评估)该物质对水有稍微危害的。
不要让未稀释或大量的产品接触地下水、水道或污水系统。
若无政府许可,勿将材料排入周围环境。
分子结构数据
暂无
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:3
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:8
8.表面电荷:0
9.复杂度:78.3
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.按规定使用和贮存的不会分解,避氧化物、水分、热、火焰。
2.对酸、碱和湿气敏感,需要在干燥条件下储存和在通风橱中使用。
贮存方法
2-8°C冷藏、干燥、密闭处、惰性气体的环境中。
合成方法
暂无
用途
(三氟甲基)三甲基硅烷(TMSCF3)在有机化学中有着非常广泛的用途,虽然该试剂的两个组成部分均可参与反应,但是以CF3 参与的反应比较重要。目前有两篇论文对该试剂的制备和反应性质进行了相当详细的综述[1,2]。
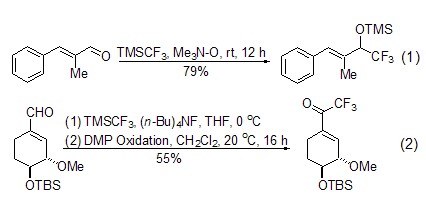
TMSCF3使用频率最高的功能是与醛和酮发生加成反应,生成相应的α-羟基三氟甲基化合物[3~7]。在催化剂存在下,该反应可以在非常温和的条件下进行。四烷基氟化铵盐是常用的催化剂,多数情况下可得到几乎定量的产率。如果使用有机叔胺的氧化物为催化剂,则可以高产率地得到α-羟基的三甲基硅醚 (式1)[6]。与醛加成后生成的α-羟基三氟甲基化合物再经适当的氧化剂氧化,成为制备α-三氟甲基酮化合物最有效的方法之一 (式2)[7]。
α,β-不饱和酮加成反应的选择性受到多种因素的影响,有时反应温度会成为1,2-或者1,4-加成的关键因素 (式3)[8]。TMSCF3 也可以方便地与酯羰基加成,内酯可以生成稳定的半缩醛产物 (式4)[9],而链状酯则生成α-三氟甲基酮化合物[10]。

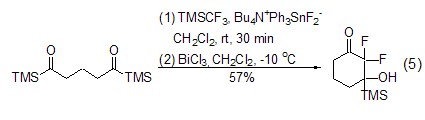
TMSCF3与三甲基硅酮反应后能够生成烯醇硅醚中间体,如果继续发生亲核反应,则得到α-二氟取代酮的衍生物 (式5)[11,12]。
TMSCF3与卤化物之间发生的C-C键生成反应可以在底物分子中引入三氟甲基官能团 (式6)[13]。在有不同卤素取代的芳环上发生的反应具有高度的化学选择性[14]。

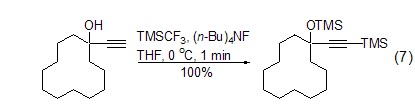
虽然TMS参与的反应对该试剂不太重要,但是,TMSCF3 与末端炔烃反应生成TMS取代炔烃还是很有意义的。一方面是该反应可在温和条件下、数分钟之内几乎定量地生成产物。另一方面,它为TMS取代炔烃合成提供了一种非强碱条件下的制备方法 (式7)[15]。
安全信息
危险运输编码:UN1993 3/PG 2
危险品标志: 易燃
易燃
危险标识:R11
文献
1. Singh, R. P.; Shreeve, J. M. Tetrahedron, 2000, 56, 7613. 2. Prakash, G. K. S.; Yudin, A. K. Chem. Rev., 1997, 97, 757. 3. Jeannot, F.; Gosselin, G.; Mathe, C. Org. Biomol. Chem., 2003, 1, 2096. 4. Holmeide, A. K.; H., Anne K.; Skatteboel, L. J. Chem. Soc. Perkin Trans. 1, 2000, 2271. 5. Lebel, H.; Paquet, V. Org. Lett. , 2002, 4, 1671. 6. Prakash, G. K. S.; Mandal, M.; Panja, C.; Mathew, T.; Olah, G. A. J. Fluorine Chem., 2003, 123, 61. 7. Rodeschini, V.; Van de Weghe, P.; Salomon, E.; Tarnus, C.; Eustache, J. J. Org. Chem., 2005, 70, 2409. 8. Sosnovskikh, V. Ya.; Usachev, B. I.; Sevenard, D. V.; Roschenthaler, G.-V. J. Org. Chem., 2003, 68, 7747. 9. Grellepois, F.; Chorki, F.; Crousse, B.; Ourevitch, M.; Bonnet-Delpon, D.; Begue, J.-P. J. Org. Chem., 2002, 67, 1253. 10. Singh, R. P.; Leitch, J. M.; Twamley, B.; Shreeve, J. M. J. Org. Chem., 2001, 66, 1436. 11. Kim, J.; Shreeve, J. M. Org. Biomol. Chem., 2004, 2, 2728. 12. Cottet, F.; Marull, M.; Lefebvre, O.; Schlosser, M. Eur. J. Org. Chem., 2003, 1559. 13. Lefebvre, O.; Brigaud, T.; Portella, C. Tetrahedron, 1999, 55, 7233. 14. Saleur, D.; Bouillon, J.-P.; Portella, C. J. Org. Chem. , 2001, 66, 4543. 15. Yoshimatsu, M.; Kuribayashi, M. J. Chem. Soc., Perkin Trans. 1, 2001, 1256. 16.参考书:现代有机bepaly tw <性质、制备和反应> ;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号