| 物竞编号 | 0RPV |
|---|---|
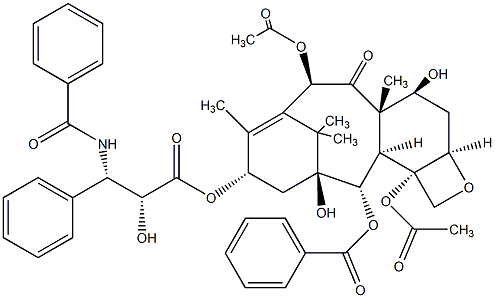
| 分子式 | C47H51NO14 |
| 分子量 | 853.91 |
| 标签 | 紫杉醇, TAXOL紫杉醇, 紫杉醇 1+% HPLC, 紫杉醇 50+% HPLC, 紫杉醇(-20℃), 合成紫杉醇, 浆果赤霉素III, 泰素, N-Benzyl-beta-phenylisoserine ester, Paclitaxel, Taxus brevifolia, Paclitaxel, taxus species, Paclitaxol, Paclitaxel, Taxol(Tm), Taxol A, Taxol equivalent, 抗肿瘤药 |
编号系统
CAS号:33069-62-4
MDL号:MFCD00869953
EINECS号:暂无
RTECS号:DA8340700
BRN号:1420457
PubChem号:24277878
物性数据
1. 性状:外观为白色结晶或无定形粉末
2. 密度(g/mL,20℃):0.2
3. 相对蒸汽密度(g/mL,空气=1):未确定
4. 熔点(ºC):71~74
5. 沸点(ºC,常压):未确定
6. 沸点(ºC,KPa):未确定
7. 折射率:-49º(C=1,MeOH)
8. 闪点(ºC):未确定
9. 比旋光度(º):未确定
10. 自燃点或引燃温度(ºC):未确定
11. 蒸气压(Pa,20ºC):未确定
12. 饱和蒸气压(KPa,20ºC):未确定
13. 燃烧热(KJ/mol):未确定
14. 临界温度(ºC):未确定
15. 临界压力(KPa):未确定
16. 油水(辛醇/水)分配系数的对数值:未确定
17. 爆炸上限(%,V/V):未确定
18. 爆炸下限(%,V/V):未确定
19. 溶解性:未确定
毒理学数据
暂无
生态学数据
暂无
分子结构数据
暂无
计算化学数据
1、 疏水参数计算参考值(XlogP):2.5
2、 氢键供体数量:4
3、 氢键受体数量:14
4、 可旋转化学键数量:14
5、 互变异构体数量:6
6、 拓扑分子极性表面积(TPSA):221
7、 重原子数量:62
8、 表面电荷:0
9、 复杂度:1790
10、同位素原子数量:0
11、确定原子立构中心数量:11
12、不确定原子立构中心数量:0
13、确定化学键立构中心数量:0
14、不确定化学键立构中心数量:0
15、共价键单元数量:1
性质与稳定性
如果遵照规格使用和储存则不会分解,未有已知危险反应。
贮存方法
棕色玻璃瓶闭光密封包装。贮存于低温干燥处。
合成方法
1.紫杉醇的制造方法有三种。第一种是合成法,第二种是细菌培养法,第三种是从红豆杉中直接分离制取。前两种方法虽已取得重大研究成果,但均未实现产业化,目前从天然或栽培的红豆杉中分离仍是生产紫杉醇的主要途径。其分离过程一般是甲醇或乙醇浸出(或超离界提取)→己烷脱酯→二氯甲烷或氯仿萃取得粗提物→多次硅胶柱层析→制备性HPLC、TLC、HSCCC纯化→重结晶得产品。由于硅胶柱层析很难将紫杉醇与另一衍生物Cephalomannine分开且产品收率低,Kingston等人采用O3选择性氧化Cephalomannine分子中的烯键,然后再经硅胶柱层析将紫杉醇纯化。近年来,采用高分子树脂进行红豆杉粗提物的脱色及分离取得很大进度,克服了原各种分离方法收率低、产量小、成本高、生长周期长等问题。
2. 7-三乙基硅烷10-脱乙酰巴卡亭Ⅲ的制备
在反应瓶中加入10-脱乙酰卡巴亭Ⅲ1.0g(1.8mmol)和无水吡啶100ml,搅拌溶解,在通N2保护下,缓慢滴加三乙基氯硅烷6.7ml(6.0g,40mmol),滴毕#反应液呈黄色#降温至0ºC,于0ºC下搅拌反应24h.加乙酸乙酯200ml和水200ml,充分搅拌后静置分层,分取有机层,用饱和硫酸铜溶液(300ml×3),洗涤,直至将过量的吡啶全部除去,用水100ml洗涤,再用饱和NaCl水溶液100ml洗涤,无水Na2SO4干燥,过滤,滤液减压蒸除溶剂,浓缩剩余物经230~400目硅胶-60(Merck)柱色谱纯化,用二氯甲烷/甲醇(体积比99:1)洗脱#得化合物7-三乙基硅烷10-脱乙酰巴卡亭Ⅲ1.12g,收率79%,mp256~257 ºC(二氯甲烷/戊烷).
3. 7-三乙基硅烷巴卡亭Ⅲ的制备
在反应瓶中加入化合物7-三乙基硅烷10-脱乙酰巴卡亭Ⅲ1.0g(1.5mmol)和无水吡啶43ml,降温至0ºC,搅拌滴加乙酰氯0.6ml,滴毕,仍在0ºC下继续搅拌反应20h.加乙酸乙酯和水各50ml,充分搅拌,静置分层,用乙酸乙酯(30ml×2)提取水相,合并有机相,用饱和硫酸铜溶液洗涤至吡啶完全除去,然后依次序用水洗、饱和氯化钠溶液洗涤. 无水NaSO4干燥,过滤,将滤液减压浓缩,浓缩剩余液经230~400目硅胶-60(Merck)柱色谱纯化[洗脱剂:二氯甲烷/甲醇(体积比99:1)],得7-三乙基硅烷巴卡亭Ⅲ1.03g, 收率86%,mp253~254ºC(二氯甲烷/戊烷).
4. [2aR-[2aα,4β, 4aβ, 6β,9α-(αR*, βS*),11α,12α,12aα,12bα]]-β-(苯甲酰氨基)-α-羟基苯丙酸6,12b-双(乙酰氧基)-12-(苯甲酰氧基)-2a,3,4,4a,5,6,9,10,11,12,12a,12b-十二氢-4,11-二羟基-4a,8,13,13-四甲基-5-氧代-7,11-亚甲基-1H-环癸并[3,4]苯并[1,2-b]氧杂丁环-9-基酯(紫杉醇)的合成
在反应瓶中加入化合物7-三乙基硅烷巴卡亭Ⅲ1.0g(1.4mmol)和无水甲苯70ml, 搅拌溶解, 再在搅拌下加入N-苯甲酰-(2R,3S)-3-苯基异丝氨酸[N-benzoyl-(2R,3S)-3-phenylisoserine]1.3g(4.6mmol),再加入碳化双(环己基亚胺)DCC470mg(4.5mmol),搅拌反应5min,后加入二甲基氨基吡啶(DMAP)350mg(2.8mmol)搅拌4min, 加热至75ºC,搅拌反应10h.冷却至室温,用适量乙酸乙酯稀释,静置分层,分取有机层,依次用饱和NaHCO3水溶液洗3次,用水洗2次用饱和NaCl水溶液洗涤2次,然后用无水Na2SO4干燥,过滤,将滤液减压浓缩,剩余浓缩液经硅胶柱色谱纯化,得C-7保护的紫杉醇衍生物,将其溶于预先冷至0ºC的含0.5%盐酸的乙醇溶液62ml中,于0ºC下通N2保护搅拌30h(用TLC跟踪确认衍生物完全消失,反应即达终点,停止反应).反应液用乙酸乙酯450ml稀释,搅拌均匀后,用水洗涤,静置分层.分取有机层,再用水洗涤5次,用饱和NaCl水溶液洗涤2次,然后用无水Na2SO4干燥,过滤,将滤液减压浓缩,经硅胶[230~400目硅胶-60(Merck)]柱色谱纯化[洗脱剂:二氯甲烷/甲醇(体积比90:10)],得含目的产物的洗脱液经后处理后的产物,再将其用含水甲醇结晶,得9..mg,收率89%,mp194~195 ºC.

用途
1.可用于治疗转移性卵巢癌及乳腺癌;也用于治疗小细胞和非细胞肺癌、宫颈癌、抗化疗白血病等。
2.本品为一种抗癌新药.它对难治的晚期转移性卵巢癌或乳腺癌有良好的抗癌活性,对小细胞和非小细胞肺癌、恶性黑色素瘤、头颈部癌等也有一定的活性.作用机理是促使细胞内形成稳定的微管束,以干扰细胞周期后的G2有丝分裂,并抑制其细胞复制.主要用于治疗晚期卵巢癌和乳腺癌,也用于治疗鳞状细胞癌、头颈部癌和黑色素瘤.
安全信息
危险运输编码:暂无
危险品标志: 有害
有害
安全标识:S22 S26 S45 S36/S37/S39
危险标识:R40 R41 R62 R68 R37/38 R42/43
文献
【1】 Merck Index.13th:7052. 【2】 罗明生主编.现代临床药物大典.成都:四川科学技术出版社,2001:981-982. 【3】 Manfredi J J,et al. Pharmacol Ther,1984,25:83-125. 【4】 Horwitz S B,et al.Ann N Acad Sci,1986,466:733-744. 【5】 Horwitz S B.Trends Pharmacol Sci,1992, N Acad Sci,13:134-136. 【6】 Sem Oncol,1993,20(Suppl3):1-60. 【7】 Runowicz C D,et al.Cancer,1993,71:1591-1596. 【8】 Holton R A,et al.J Am Chem Soc,1988,110:6558. 【9】 Holton R A,et al.J Am Chem Soc,1994,116:1597,1599. 【10】 Nicolaou K C,et al.Nature,1994,367:630-632. 【11】 陈冲等.中国医药工业杂志,1997,28:375-376. 【12】 Denis J N,et al.J Am Chem Soc,1988,110:5917-5919. 【13】 岳琴等.药学学报,1996,31:911-917. 【14】 Chmurny G N,et al.J Nat Prod,1992,55:414-423. 【15】 阎家麒等.中国医学工业杂志,1996,27:455-457. 【16】 王九一等.中国药物化学杂志,1999,9:56-58.
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号