| 物竞编号 | 03LE |
|---|---|
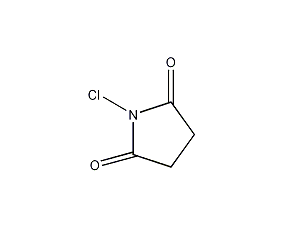
| 分子式 | C4H4ClNO2 |
| 分子量 | 133.53 |
| 标签 | N-氯代琥珀酰亚胺, N-氯丁二酰亚胺, 琥珀酰基氯亚胺, 琥珀酰氯亚胺, 氯代丁二酰亚胺, 氯代二乙酰亚胺, NCS, 氯化剂 |
编号系统
CAS号:128-09-6
MDL号:MFCD00005511
EINECS号:204-878-8
RTECS号:UY1013500
BRN号:暂无
PubChem号:24852348
物性数据
1. 性状:白色粉末或晶体
2. 熔点(oC):150~152
3. 溶解性:1g N-氯代丁二酰亚胺溶解于约70ml水、150ml乙醇或50ml苯中,微溶于醚、氯仿和四氯化碳。
毒理学数据
1、急性毒性:大鼠经口LDLO:1gm/kg;大鼠经静脉注射LDLO:200mg/kg
2、其他多剂量毒性:大鼠经口TDLO:15gm/kg/40D-I;兔子经口TDLO:5800mg/kg/5W-I
3、致肿瘤:小鼠经皮下TDLO:840mg/kg/70W-I
生态学数据
暂无
分子结构数据
1、 摩尔折射率:27.46
2、 摩尔体积(cm3/mol):88.6
3、 等张比容(90.2K):236.1
4、 表面张力(dyne/cm):50.4
5、 极化率(10-24cm3):10.88
计算化学数据
1.疏水参数计算参考值(XlogP):-0.2
2.氢键供体数量:0
3.氢键受体数量:2
4.可旋转化学键数量:0
5.互变异构体数量:3
6.拓扑分子极性表面积37.4
7.重原子数量:8
8.表面电荷:0
9.复杂度:129
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
对湿气敏感,应保存在干燥器中。使用过程中,应避免吸入或粘在皮肤上,一般在通风性能良好的通风橱中操作。
腐蚀性物质。吞咽有害,会导致灼伤。万一接触眼睛,立即使用大量清水冲洗并送医诊治,使用合适的手套和防护眼镜或者面罩。
贮存方法
储存在干燥容器内。
合成方法
将4.96g(0.05mol)丁二酰亚胺溶于17ml乙酸和15ml水的混合溶剂中,在搅拌下加入5.6g(0.05mol)次氯酸叔丁酯(见本书第43页),然后在0℃静置1h.析出沉淀,过滤,固体真空干燥,得2.07g,产率31.3%。熔点149~150℃。
用途
1.重要的氯化剂,能将芳醛氯化而芳环不受影响。在苯胺、N-烷基苯胺的氯代(邻位为主),a-氨基吡啶氯代,a-苯硫基酰胺脱氢氯代和降解氯化,以及环戊二烯单氯化反应中都比用氯气、次氯酸叔丁酯、氯胺T等的产率更高。作为氧化剂,可将二醇氧化成内酯,伯(仲)醇氧化为醛(酮),B-羟基酮氧化成B-二酮等。在酸性条件下能选择性断裂色氨酸形成的肽键。也可用于烯丙胺、B,R-不饱和氨基酸极其衍生物的合成。
2.医药中间体。常用于抗菌素的合成,如苄基头孢菌素,也可用于制备橡胶助剂。
3.N-氯代丁二酰亚胺 (NCS) 是一种比较方便的亲电加成和亲电取代试剂,常用于硫化物、砜和酮的氯化,也可用来合成N-氯化胺。
羰基化合物的α-位氯化反应 在锂或其它试剂等的作用下,NCS可使羰基化合物的α-位氯化 (式1)[1~3]。
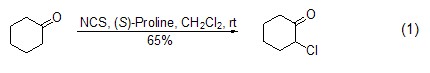
如果在手性催化剂的存在下,NCS可在羰基化合物的α-位发生不对称氯化 (式2)[4,5]。
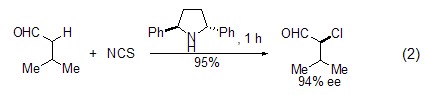
亚砜的催化还原 在NCS的催化下,亚砜能够被还原为硫醚类化合物 (式3)[6]。
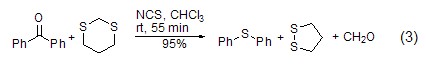
氧化反应 NCS也可作为氧化剂,将不饱和键转化为相应的饱和键,如烯醇酯在NCS的氧化作用下发生氰化反应,生成饱和氰化胺 (式4)[7]。

芳香化合物的氯化 NCS可使芳香型化合物 (式5)[8]、噻吩类化合物 (式6)[9] 和氮杂环化合物氯化 (式7)[10,11]。
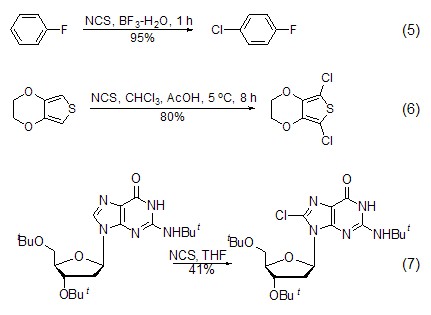
N-氯代氨基化合物的合成 在NCS作用下,二级胺可转化为N-氯代氨基化合物 (式8)[12]。

醇羟基的氯化 NCS除了可使胺发生N-氯化反应以外,还可与醇类化合物在羟基部位发生氯化。在手性催化剂的存在下,NCS可以选择性地与某一构型的手性醇反应,从而实现醇的拆分 (式9)[13]。

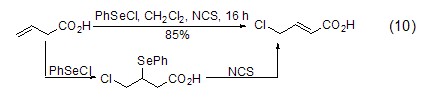
与烯烃的反应 在催化剂如PhSeCl的作用下,NCS也可将烯烃进行氯化,该反应经历亲电加成得到氯化物后,催化剂复原即得到最终产物 (式10)[14]。
安全信息
危险运输编码:暂无
危险品标志: 腐蚀
腐蚀
安全标识:S26 S45 S36/S37/S39
文献
1. Marigo, M.; Bachmann, S.; Halland, N.; Braunton, A.; Jorgensen, K. A. Angew. Chem., Int. Ed., 2004, 43, 5507. 2. Menichincheri, M.; Ballinari, D.; Bargiotti, A.; Bonomini, L.; Ceccarelli, W.; D'Alessio, R.; Fretta, A.; Moll, J.; Polucci, P.; Soncini, C.; Tibolla, M.; Trosset, J.-Y.; Vanotti, E. J. Med. Chem., 2004, 47, 6466. 3. Freihammer, P. M.; Detty, M. R. J. Org. Chem., 2000, 65, 7203. 4. Halland, N.; Braunton, A.; Bachmann, S.; Marigo, M.; Jørgensen, K. A. J. Am. Chem. Soc., 2004, 126, 4790. 5. Brochu, M. P.; Brown, S. P.; MacMillan, D. W. C. J. Am. Chem. Soc., 2004, 126, 4108. 6. Iranpoor, N.; Firouzabadi, H.; Shaterian, H. R. J. Org. Chem., 2002, 67, 2826. 7. Shimizu, M.; Itou, H.; Miura, M. J. Am. Chem. Soc., 2005, 127, 3296. 8. Prakash, G. K. S.; Mathew, T.; Hoole, D.; Esteves, P. M.; Wang, Q.; Rasul, G.; Olah, G. A. J. Am. Chem. Soc., 2004, 126, 15770. 9. Meng, H.; Perepichka, D. F.; Bendikov, M.; Wudl, F.; Pan, G. Z.; Yu, W.; Dong, W.; Brown, S. J. Am. Chem. Soc., 2003, 125, 15151. 10. Hamm, M. L.; Rajguru, S.; Downs, A. M.; Cholera, R. J. Am. Chem. Soc., 2005, 127, 12220. 11. Eldrup, A. B.; Prhavc, M.; Brooks, J.; Bhat, B.; Prakash, T. P.; Song, Q.; Bera, S.; Bhat, N.; Dande, P.; Cook, P. D.; Bennett, C. F.; Carroll, S. S.; Ball, R. G.; Bosserman, M.; Burlein, C.; Colwell, L. F.; Fay, J. F.; Flores, O. A.; Getty, K.; LaFemina, R. L.; Leone, J.; MacCoss, M.; McMasters, D. R.; Tomassini, J. E.; Von Langen, D.; Wolanski, B.; Olsen, D. B. J. Med. Chem., 2004, 47, 5284. 12. Abia, L.; Armesto, X. L.; Canle, M.; Garcia, M. V.; Santabella, J. A. Tetrahedron, 1998, 54, 521. 13. Sekar, G.; Nishiyama, H. J. Am. Chem. Soc., 2001, 123, 3603. 14. Tunge, J. A.; Mellegaard, S. R. Org. Lett., 2004, 6, 1205. 15.参考书:现代有机bepaly tw <性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无









 沪公网安备 31010602001115号
沪公网安备 31010602001115号