| 物竞编号 | 02UY |
|---|---|
| 分子式 | C2H6O2 |
| 分子量 | 62.07 |
| 标签 | 甘醇, 亚乙基二醇, 1,2-ethanediol, Glycol, Ethylene alcohol, 脂肪族醇类、醚类及其衍生物, 油墨所用原料及中间体 |
编号系统
CAS号:107-21-1
MDL号:MFCD00283324
EINECS号:203-473-3
RTECS号:KW2975000
BRN号:505945
PubChem号:24859450
物性数据
1.性状:无色透明微有黏稠性液体。味微甜。易吸潮。无气味。
2.沸点(ºC,101.3kPa):197.3
3.熔点(ºC):-13~-11
4.相对密度(g/mL,0/4ºC):1.1274
5.相对密度(g/mL,10/4ºC):1.1204
6.相对密度(g/mL,20/4ºC):1.1135
7.相对蒸汽密度(g/mL,空气=1):2.14
8.折射率(15ºC):1.43312
9.折射率(20ºC):1.4318
10.黏度(mPa·s,-7ºC):86.9
11.黏度(mPa·s,16ºC):25.66
12.黏度(mPa·s,38ºC):10.38
13.闪点(ºC):111.1
14.燃点(ºC):118
15.蒸发热(KJ/mol):57.11
16.熔化热(KJ/kg):187.2
17.生成热(KJ/mol):-452.6
18.燃烧热(KJ/mol,20ºC,定压):1186.1
19.燃烧热(KJ/kg,20ºC,定压):1186.1
20.比热容(KJ/(kg·K),定压):2.35
21.电导率(S/m,25ºC):1.07×10-6
22.热导率(W/(m·K),20ºC):0.28888
23.爆炸下限(%,V/V):3.2
24.爆炸上限(%,V/V):15.3
25.体膨胀系数(K-1):0.000566
26.凝固点(ºC):-11.5
27.自燃点(ºC):412.8
28.蒸气压(kPa,50ºC):0.09
29.溶解性:能与水、乙醇、丙酮、乙酸、甘油、吡啶等混溶。但对氯仿、乙醚、苯、二硫化碳等难溶,对烃类、氯代烃、油类、橡胶、天然树脂等则不溶解。能溶解食盐、氯化锌、碳酸钾、氯化钾、碘化钾、氢氧化钾等无机化合物。
30.相对密度(25℃,4℃):1.1100
31.常温折射率(n25):1.4306
32.临界温度(ºC):446.85
33.临界压力(MPa):8
34.溶度参数(J·cm-3)0.5:34.478
35.van der Waals面积(cm2·mol-1):5.620×109
36.van der Waals体积(cm3·mol-1):36.540
37.气相标准燃烧热(焓)(kJ·mol-1):-1256.96
38.气相标准声称热(焓)( kJ·mol-1) :-387.56
39.气相标准熵(J·mol-1·K-1) :303.81
40.气相标准生成自由能( kJ·mol-1):-296.6
41.气相标准热熔(J·mol-1·K-1):82.7
42.液相标准燃烧热(焓)(kJ·mol-1):-1189.18
43.液相标准声称热(焓)( kJ·mol-1):-455.34
44. 液相标准熵(J·mol-1·K-1) :153.39
45.液相标准生成自由能( kJ·mol-1):-319.74
46.液相标准热熔(J·mol-1·K-1):149.6
毒理学数据
1、毒性分级:中毒
2、刺激数据:皮肤- 兔子 555 毫克 轻度; 眼睛 -兔子 500 毫克/ 24小时 轻度。
3、本品对低级脊椎动物无严重毒性,但对人类则不同。由于本品沸点高,蒸气压低,一般不存在吸入中毒现象。对未破损皮肤的渗入量小。对眼可引起刺激。但大量饮用(个别人不足50g)会刺激中枢神经,引起呕吐、疲倦、昏睡、呼吸困难、震颤、肾脏充血和出血、脂肪肝、尿闭(肾小管结晶阻塞)、支气管炎、肺炎而致死。对人的致死量为100ml。大鼠经口LD50为5.5~5.8ml/kg。小鼠经口LD50为1.31~13.8ml/kg。嗅觉阈浓度90mg/m3。工作场所最高容许浓度为125mg/m3(美国)。
生态学数据
该物质对水有稍微的危害。
分子结构数据
1、 摩尔折射率:14.38
2、 摩尔体积(cm3/mol):56.5
3、 等张比容(90.2K):145.1
4、 表面张力(dyne/cm):43.4
5、 介电常数:
6、 偶极距(10-24cm3):
7、 极化率:5.70
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:2
3.氢键受体数量:2
4.可旋转化学键数量:1
5.互变异构体数量:无
6.拓扑分子极性表面积40.5
7.重原子数量:4
8.表面电荷:0
9.复杂度:6
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.避免与强氧化剂、强酸接触。可燃性液体。对金属无腐蚀,由于吸湿性强应密封贮存。低温场所应采取保温措施,以防止黏度上升和凝固。着火时用泡沫灭火剂、二氧化碳、干式化学灭火剂、四氯化碳等灭火。误服者立即用1∶2000高锰酸钾溶液洗胃和导泻。严重者送医院诊治。操作人员应穿戴防护用具,定期进行体检,特别是尿常规检查。
2.化学性质
① 酯化反应与有机酸或无机酸反应生成酯。例如与二元酸反应生成聚酯纤维或聚酯树脂。与盐酸反应生成2-氯乙醇。与硝酸反应生成硝酸酯。
② 醚化反应与硫酸烷基酯和氢氧化钠反应生成烷基醚。
③ 缩醛的生成在酸性催化剂作用下,与醛反应生成环缩醛。
④ 脱水反应用硫酸或氧化锌脱水,生成二烷、乙醛、巴豆醛等。
⑤ 氧化反应硝酸氧化、气相氧化生成乙二醛、羟基乙酸、草酸等。
⑥ 醇金属的生成经碱金属或碱性氢氧化物处理变成醇金属。
⑦ 和环氧乙烷反应生成二甘醇、三甘醇以及高分子的聚乙二醇。
3.对低级脊椎动物无严重毒性,但对人类则不同。由于乙二醇沸点高,蒸气压低,一般不存在吸入中毒现象。对未破损皮肤的渗入量小。对眼可引起刺激。但大量饮用(个别人不足50g)会刺激中枢神经,引起呕吐、疲倦、昏睡、呼吸困难、震颤、肾脏充血和出血、脂肪肝、尿闭(肾小管结晶阻塞)、支气管炎、肺炎而致死。大鼠、豚鼠经口LD50分别为8.54g/kg、6.61g/kg,小鼠经口LD5013.79mL/kg。人体LD约1.4mL/kg或100mL。误服者立即用1:2000高锰酸钾溶液洗胃和导泻。严重者送医院诊治。
4.进入体内有致命危险,长时间吸入蒸气亦有害;对眼有刺激性;可能破坏肾脏或神经系统。使用时应在通风橱中进行。
5.乙二醇有毒,能引起恶心和呕吐,较大剂童中毒时引起昏迷和抽搐。
6. 存在于烟气中。
贮存方法
1.储存于阴凉、通风的库房。远离火种、热源。应与氧化剂、酸类分开存放,切忌混储。配备相应品种和数量的消防器材。储区应备有泄漏应急处理设备和合适的收容材料。由于吸湿性强,应密封贮存,长期贮存要用氮气密封。可用铁、软钢、铜或铝制容器贮存。但长期贮存时宜用涂覆的钢、铝或不锈钢制容器。
2.乙二醇容器上应标明“有毒”字样,防止误服及吸入乙二醇蒸气。操作人员应穿戴防护用具,定期进行体检,特别是尿常规检查。
用镀锌铁桶包装,每桶100kg或200kg。贮存时应密封,长期贮存要氮封、防潮、防火、防冻。按易燃beplay体育首页 规定贮运。
合成方法
1. 氯乙醇法
以氯乙醇为原料在碱性介质中水解而得,该反应在
2. 环氧乙烷水合法
环氧乙烷水合法有直接水合法和催化水合法,水合过程在常压下进行也可在加压下进行。常压水合法一般采用少量无机酸为催化剂,在50~
直接水合法:
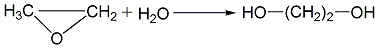
催化水合法:
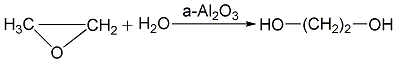
加压水合法 环氧乙烷与水的摩尔比要较高,在1∶6以上,以减少生成醚的副反应,该反应的温度在
3.目前有气相催化水合法,以氧化银为催化剂,氧化铝为载体,在150~
4.乙烯直接水合法 乙烯在催化剂(如氧化锑TeO2,钯催化剂)存在下在乙酸溶液中氧化生成单乙酸酯或二乙酸酯,进一步水解均得乙二醇。
5.环氧乙烷与水在硫酸催化剂作用下进行水合反应,反应液经碱中和、蒸发、精馏即得成品。或者环氧乙烷和水在一定温度和压力下制得乙二醇,同时副产二乙二醇、三乙二醇和多乙二醇。反应液经蒸发浓缩、脱水、精制得合格产品和副产品。
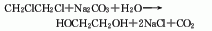
6.甲醛法 其反应式如下:
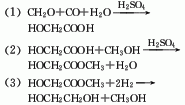
7.以工业品乙二醇为原料,经减压蒸馏,于1333Pa下,收集中间馏分即可。
8.将乙二醇真空蒸馏,所得主要馏分用无水硫酸钠进行较长时间干燥,然后用一支好的分馏柱重新真空蒸馏。
用途
1.用于制造树脂、增塑剂、合成纤维、化妆品和炸药, 并用作溶剂、配制发动机的抗冻剂。主要用作聚酯纤维涤纶的原料。也用于制造聚酯树脂、增塑剂、化妆品、炸药、防冻液、耐寒润滑油、表面活性剂等。还用作清漆、染料、油墨、某些无机化合物的溶剂以及气体脱水剂、肼的萃取剂等。
乙二醇主要用于配制汽车冷却系统的抗冻剂及生产聚对苯二甲酸乙二酯(聚酯纤维和聚酯塑料的原料),也可用于生产其分合成树脂、溶剂、润滑剂、表面活性剂、软化剂、增湿剂、炸药等。乙二醇常可代替甘油使用,在制革和制药工业中分别用作水合剂和溶剂。乙二醇的溶解能力很强,但它容易代谢氧化生成有毒的草酸,因而不能广泛用作溶剂。将乙二醇添加到液压流体中,可防止油基液压流体对系统中橡胶的侵蚀;以乙二醇为主要组分的水基液压流体是一种不能燃烧的液压流体,运用于飞机、汽车和高温作业的模压机。乙二醇有许多重要的衍生物。低分子量聚乙二醇(一缩乙二醇、二缩乙二醇、三缩乙二醇或分别称二甘醇、三甘醇、四甘醇)实际上是环氧乙烷水合制得乙二醇的副产物。二甘醇可用作增湿剂、增塑剂、上浆剂、印刷油墨溶剂、天然气脱水干燥剂和芳烃萃取溶剂。二甘醇二硝酸酯与乙二醇二硝酸酯相似,也是一种重要的工业炸药。高分子量聚乙二醇根据分子量的不同,从无色透明粘稠液体到蜡状固体,也是一类有用的衍生物。用作润滑剂、水分保持剂、溶剂以及橡胶和食品工业的中间体,亦用于配制化妆品以及纺织、造纸等领域的助剂。乙二醇的酯品种很多,广泛用作溶剂。长链脂肪酸的乙二醇酯具有表面改进性能,可单独使用或与其了表面活性剂共用,作为乳化剂、稳定剂、分散剂、增湿剂、发泡剂和悬浮剂等。乙二醇与尿素反应生成环亚乙基脲,用于纺织工业。乙二醇二钠与1,2-二溴乙烷反应,生成二氧六环,这是一种特殊的溶剂。对乙二醇采用不同的氧化剂或反应条件。氧化后可得到乙醇醛、乙二醛、乙醇酸、草酸等。
2.用作分析试剂,可作液相色谱洗脱剂,电化学分析非水介质。也用作溶剂、抗冻剂,并用于有机合成。
3.用于电子工业。可作清洗去油剂。
4.乙二醇是一种化学实验室常备的多功能试剂。它可以与醛、酮形成缩醛或缩酮来保护羰基;可以作为Diels-Alder反应或Fischer吲哚合成的溶剂;可以用于由三烷基硼制备三级醇等。
形成缩醛和缩酮 乙二醇是保护羰基最常用的化合物之一。缩醛、缩酮基团对碱、格氏试剂、烷基锂试剂、金属氢化物、Wittig试剂以及氧化、还原、溴化、酯化等反应条件均稳定。形成缩醛或缩酮的难易顺序为:醛 > 无环脂肪酮 >六元环酮 > 五元环酮 > α,β-不饱和酮 > α-单取代或二取代酮 >> 芳香酮。酮反应时,需要比醛更强的酸性条件,比如HCl、TsOH (式1)[1~4]。
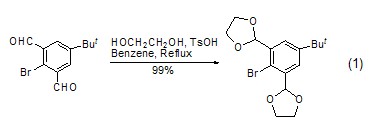
用作反应溶剂 乙二醇是许多反应的良好溶剂,它的沸点高 (197.6 oC),熔点低 (–13 oC),使得操作温度范围大为扩展,可以作为150 oC以上反应的溶剂 (式2)[5,6]。
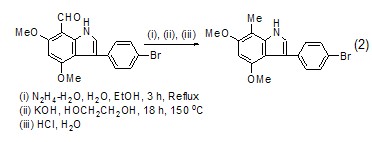
乙二醇也可作为合成稠环化合物的溶剂,例如在Ru催化剂催化下,炔烃衍生物与取代的苯胺反应合成吲哚环[7]。与传统方法相比,该方法的反应条件更为温和 (式3)。
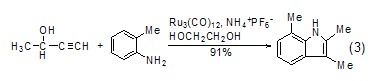
双烯与亲双烯体进行Diels-Alder反应时,乙二醇作为溶剂比苯、MeCN、DMSO、MeOH等更加优越,反应速率要高 (式4)[8,9]。
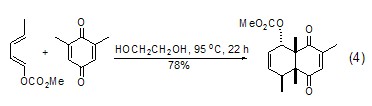
反应成酯 作为带有醇羟基的化合物,乙二醇能够与羧酸类化合物反应成酯 (式5)[10]。

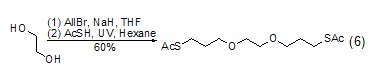
反应成醚 乙二醇也能够与醇、卤代物等反应成醚 (式6)[11,12]。
安全信息
危险运输编码:UN3082 9/PG 3
危险品标志: 易燃
易燃  有害
有害
安全标识:S26
文献
1. Zade, S. S.; Panda, S.; Singh, H. B.; Sunoj, R. B.; Butcher, R. J. J. Org. Chem., 2005, 70, 3693. 2. Serwinski, P. R.; Esat, B.; Lahti, P. M.; Liao, Y.; Walton, R.; Lan, J. J. Org. Chem., 2004, 69, 5247. 3. Suo, Z.; Drobizhev, M.; Spangler, C. W.; Christensson, N.; Rebane, A. Org. Lett., 2005, 7, 4807. 4. Zhao, L.; Lu, X.; Xu, W. J. Org. Chem., 2005, 70, 4059. 5. Keawin, T.; Rajviroongit, S.; Black, D. S. Tetrahedron, 2005, 61, 853. 6. Ericsson, C.; Engman, L. J. Org. Chem., 2004, 69, 5143. 7. Tokunaga, M.; Ota, M.; Haga, M. A.; Wakatsuki, Y. Tetrahedron Lett., 2001, 42, 3865. 8. Dunams, T.; Hoekstra, W.; Pentaleri, M.; Liotta, D. Tetrahedron Lett., 1988, 29, 3745. 9. Nakai, Y.; Uozumi, Y. Org. Lett., 2005, 7, 291. 10. Maki, T.; Ishihara, K.; Yamamoto, H. Org. Lett., 2005, 7, 5047. 11. Solomon, D.; Kitov, P. I.; Paszkiewicz, E.; Grant, G. A.; Sadowska, J. M.; Bundle, D. R. Org. Lett., 2005, 7, 4369. 12. Guidry, E. N.; Cantrill, S. J.; Stoddart, J. F.; Grubbs, R. H. Org. Lett., 2005, 7, 2129. 13.参考书:现代有机bepaly tw <性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无






 沪公网安备 31010602001115号
沪公网安备 31010602001115号