| 物竞编号 | 0JS1 |
|---|---|
| 分子式 | CuCl2 |
| 分子量 | 134.45 |
| 标签 | 媒染剂, 氧化剂, 防腐剂, 食品添加剂, 消毒剂 |
编号系统
CAS号:7447-39-4
MDL号:MFCD00010972
EINECS号:231-210-2
RTECS号:暂无
BRN号:暂无
PubChem号:24845369
物性数据
1. 性状:黄色或黄褐色的、具有潮解性的结晶性粉末。
2. 密度(g/mL,25/4℃): 3.386
3. 相对蒸汽密度(g/mL,空气=1):无可用
4. 熔点(ºC):620
5. 沸点(ºC,常压):993
6. 沸点(ºC,5.2kPa): 无可用
7. 折射率: 无可用
8. 闪点(ºC): 无可用
9. 比旋光度(º):无可用
10. 自燃点或引燃温度(ºC):无可用
11. 蒸气压(kPa,25ºC):无可用
12. 饱和蒸气压(kPa,60ºC):无可用
13. 燃烧热(KJ/mol):无可用
14. 临界温度(ºC):无可用
15. 临界压力(KPa):无可用
16. 油水(辛醇/水)分配系数的对数值:无可用
17. 爆炸上限(%,V/V):无可用
18. 爆炸下限(%,V/V): 无可用
19. 溶解性:溶于醇、丙酮和醚。
毒理学数据
1 。
试验方法:腹腔
摄入剂量: 7400微克/千克
测试对象:啮齿动物-鼠
毒性类型:急性
毒性作用:详细的毒副作用没有报告以外的其他致死剂量值
2 。
试验方法:静脉
摄入剂量: 1.75万微克/千克
测试对象:啮齿动物-鼠
毒性类型:急性
毒性作用: 详细的毒副作用没有报告以外的其他致死剂量值
3 。
试验方法:吸入
摄入剂量: 20 ug/m3/26W-I
测试对象:啮齿动物-鼠
毒性类型: MutipleDose
毒性作用: 1.改变白细胞(白血球)计数
2.体内的氯变化
生态学数据
该物质对环境可能有危害,对水体应给予特别注意。
分子结构数据
1、 摩尔折射率:无可用
2、 摩尔体积(cm3/mol): 无可用
3、 等张比容(90.2K):无可用
4、 表面张力(dyne/cm):无可用
5、 极化率:无可用
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:0
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:3
8.表面电荷:0
9.复杂度:2.8
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1. 如果遵照规格使用和储存则不会分解。
2. 无水氯化铜在993℃时分解为氯化亚铜;氯化铜易溶于水及乙醇,也溶于丙酮。
贮存方法
密封于阴凉干燥环境。
合成方法
1.将纯的二水合氯化铜CuCl2·2H2O用稀盐酸重结晶,以除去其中的碱式盐。然后将其放在干燥的氯化氢气流中,于140~150℃下脱水,直至重量不再减少时为止。将所得无水物置于盛有浓硫酸和氢氧化钠的干燥器中,以除去附着在晶体上的氯化氢。
用途
1.用作媒染剂、氧化剂、木材防腐剂、食品添加剂、消毒剂等,也用于石油馏分的脱臭和脱硫、金属提炼、照相等。
2.氯化铜可以作为氯化试剂、氧化试剂和路易斯酸试剂。
氯化铜是一个对多种官能团化合物有效的氯化试剂,能实现羰基化合物如丁醛的α-氯化反应。反应通常在含氯化锂的极性溶剂中进行。当反应在质子溶剂如甲醇中进行时,则得到α-氯化二甲基乙羧醛 (式1)[1]。
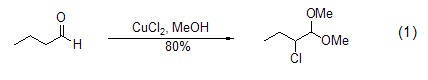
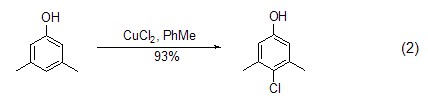
氯化铜也能实现芳香环化合物的氯化反应,如在四氯化碳中作用于苯酚或烷氧基苯化合物实现邻位或对位的氯化反应 (式2)[2]。
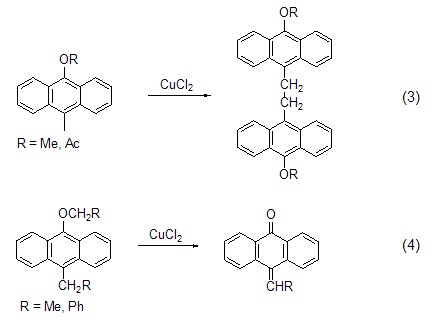
含活泼亚甲基的化合物如9-烷氧基-10-甲基蒽与氯化铜反应能得到偶联产物 (式3),然而结构相似的9-烷基-苄基蒽在氯化铜作用下则发生自由基反应得到10-苯亚甲基蒽 (式4)[3]。
酮或酯在二异丙基氨基锂LDA作用下得到的锂化烯醇式结构能被氯化铜氧化为1,4-二羰基化合物。如叔丁基甲基酮和苯乙酮在LDA和氯化铜作用下发生交叉偶联反应 (式5)[4]。
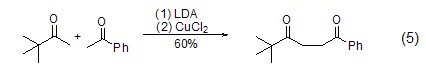
氯化铜能催化β-二羰基化合物对芳基偶氮烯烃的1,4-加成反应,得到相应的吡咯衍生物 (式6)[5]。此外,氯化铜还能催化水、醇和芳香胺对芳基偶氮烯烃的加成反应 (式7)[6]。
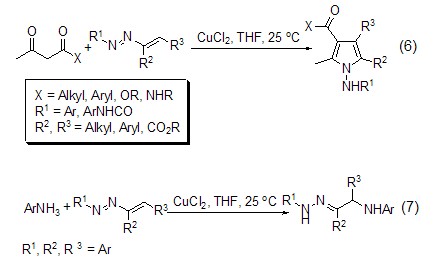
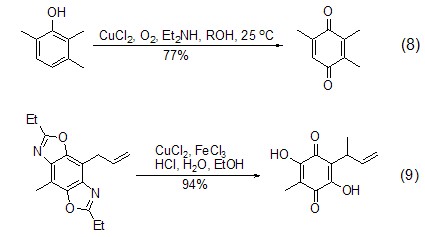
在氧气存在下,氯化铜能氧化苯酚为苯醌化合物。如在CuCl2/胺/O2催化下将2,3,6-三甲基苯酚转换为三甲基对苯醌 (式8)[7]。此外,烷氧基苯酚,甚至苯并唑也能被氯化铜和氯化铁体系氧化 (式9)[8]。
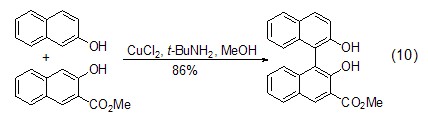
氯化铜和胺形成的配合物能有效催化2-萘酚的氧化偶联反应,得到对称的1,1' -二萘基-2,2'-二酚 (式10)[9]。
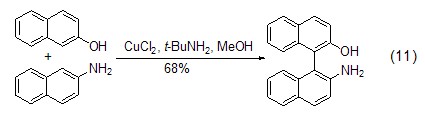
除了胺配体外,烷氧基配体也能与氯化铜作用实现萘酚的氧化偶联,并且选择不同的配体和控制氯化铜与配体的比例能选择性实现底物的自身偶联或交叉偶联反应。如在苄胺配体存在下实现萘酚与萘胺的交叉偶联反应 (式11)[10]。
氯化铜还能催化烷基和芳基磺酰氯对不饱和键的加成反应,如苯磺酰氯与烯烃在氯化铜和碱作用下发生加成反应得到乙烯基砜 (式12)[11],苯磺酰氯与苯乙炔在氯化铜和不同添加剂作用下得到顺式或反式β-氯乙烯基砜的反应 (式13)[12]。
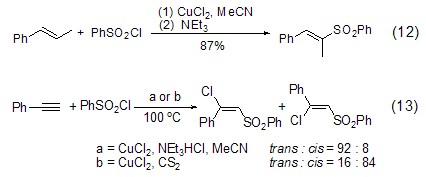
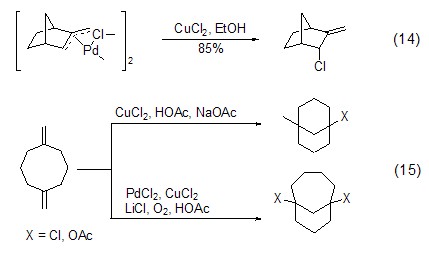
氯化铜还能与钯配合物反应,如π-烯丙基钯配合物在氯化铜作用下发生氧化断裂反应,释放出氯化钯,同时得到烯丙基氯化合物(式14)[13]。这种氯化铜对钯配合物的作用可用于实现烯丙基化合物的二聚反应,如1,5-二亚甲基环辛烷在氯化钯和氯化铜作用下发生关环反应 (式15)[14]。
此外,氯化铜还能作为钯试剂催化反应中的氧化剂,将还原消除反应后得到的低价钯试剂重新氧化为Pd(II) 进入催化循环,从而实现催化反应 (式16)[15]。
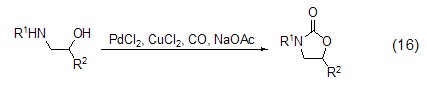
安全信息
危险运输编码:UN 3264 8/PG 3
危险品标志: 危害环境
危害环境
安全标识:S61
危险标识:R51/53
文献
Gastro, C. E.; Gaughan, E. J.; Owsley, D. C. J. Org. Chem., 1965, 30, 587. 2. Crocker, H. P.; Walser, R. Chem. Commun., 1970, 1982. 3. Nonhebel, D. C.; Russell, J. A.Tetrahedron, 1970, 26, 1123. 4. Ito, Y.; Konoike, T.; Tarada, T.; Saegusa, T. J. Am. Chem. Soc., 1977, 99, 1487. 5. Attansi, O.; Santeusanio, S. Synthesis, 1983, 742. 6. Attansi, O.; Filippone, P. Synthesis, 1984, 422. 7. Shimizu, M. Watanabe, Y. Orita, H.; Hayakawa, T.; Takehira, K. Bull. Chem. J., 1992, 65, 1522. 8. Hegedus, L. S.; Odle, R. R.; Winton, P. M; Weider, P. R. J. Org. Chem., 1982, 47, 2607. 9. Brussee, J.; Groenendijk, J. L. G.; Koppele, J. M.; Jansen, A. C. A. Tetrahedron, 1985, 41, 3313. 10. Smrcina, M.; Lorenc, M.; Hanus, V.; Kocovky, P. Synlett, 1991, 231. 11. Asscher, M.; Vofsi, D. J. Chem. Soc., 1964, 4962. 12. Amiel, Y. Tetrahedron Lett., 1971, 661. 13. Castanet, Y.; Petit, F. Tetrahedron Lett., 1979, 34, 3221. 14. Heumann, A.; Reglier, M.; Waegell, B. Tetrahedron Lett., 1983, 24, 1971. 15. Tam, W. J. Org. Chem., 1986, 51, 2977.
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号