| 物竞编号 | 0JS0 |
|---|---|
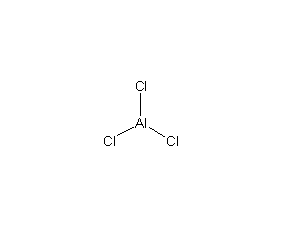
| 分子式 | AlCl3 |
| 分子量 | 133.34 |
| 标签 | 氯化铝, 三氯化铝, 脱水剂, 高分子合成的催化剂 |
编号系统
CAS号:7446-70-0
MDL号:MFCD00003422
EINECS号:231-208-1
RTECS号:BD0525000
BRN号:暂无
PubChem号:24845381
物性数据
1.性状:白色颗粒或粉末,有强盐酸气味。工业品呈淡黄色。[15]
2.熔点(℃):190~194[16]
3.沸点(℃):182.7(升华)[17]
4.相对密度(水=1):2.44[18]
5.饱和蒸气压(kPa):0.13(100℃)[19]
6.临界压力(MPa):2.63[20]
7.溶解性:易溶于水、乙醇、氯仿、四氯化碳,微溶于苯。[21]
毒理学数据
1 、
试验方法:口服
摄入剂量: 9380 mg/kg/52D-I
测试对象:啮齿动物-鼠
毒性类型: MutipleDose
毒性作用: 1).磷的变化
2、
试验方法:口服
摄入剂量: 2307 mg/kg/26W-I
测试对象:啮齿动物-鼠
毒性类型: MutipleDose
毒性作用: 1).改变电机活动(具体分析)
2).血清中成分的变化(如茶多酚,胆红素,胆固醇)
3).诱导或改变血液或组织水平-磷酸酶
3 、
试验方法:口服
摄入剂量: 100 mg/kg/48W-C
测试对象:啮齿动物-鼠
毒性类型: MutipleDose
毒性作用: 1).改变电机活动(具体分析)
2).改变操作条件反射
对皮肤、黏膜有刺激作用。当人体接触无水氯化铝,并同时接触水时,能剧烈灼烧皮肤。吸入高浓度可引起支气管炎和支气管哮喘。
4.急性毒性[22] LD50:3730mg/kg(大鼠经口)
5.刺激性[23] 家兔经皮:10%,重度刺激(开放性刺激试验)
6.亚急性与慢性毒性[24] 用含355ppm本品的饲料喂40d,观察中毒动物的肝、脾、肾,可见铝在体内对磷代谢有明显影响,可阻碍其吸收。小鸡饲料中达4400ppm时,可致严重佝偻病。
7.致突变性[25] DNA损伤:大鼠腹水瘤500μmol/L。细胞遗传学分析:小鼠腹腔内444mg/kg。
8.致畸形[26] 大鼠孕后14~18d腹腔内给予最低中毒剂量(TDLo)500mg/kg,致肌肉骨骼系统发育畸形。
生态学数据
1.生态毒性[27] LC50:80mg/L(48h)(斑马鱼);27.1mg/L(96h)(食蚊鱼);3.9mg/L(48h)(水蚤,静态)
2.生物降解性 暂无资料
3.非生物降解性 暂无资料
分子结构数据
1、摩尔折射率:无可用的
2、摩尔体积(cm3/mol):无可用的
3、等张比容(90.2K):无可用的
4、表面张力(dyne/cm):无可用的
5、介电常数:无可用的
6、极化率(10-24cm3):无可用的
7、单一同位素质量:131.888096 Da
8、标称质量:132 Da
9、平均质量:133.3405 Da
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:0
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:4
8.表面电荷:0
9.复杂度:8
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.易溶于水,生成六水合物(AlCl3·6H2O),同时放出大量热。也溶于乙醇、乙醚等有机溶剂中,易吸收水分并水解而放出氯化氢。可与许多无机、有机化合物生成络合物。其蒸气通过熔融铝的表面时,而生成易挥发的一氯化铝,冷却后,金属铝沉积而制得高纯铝。吸收空气中的水分即发生水解,大量地放出氯化氢的白色烟雾,还易蒸发。易溶于盐酸中,可与氨按各种比例结合,可溶于多数有机溶剂,特别是硝基化合物及氯化物。
2.遇水后发热引起爆炸。有强腐蚀性,能与很多无机和有机化合物生成配合物与氯化钠、氯化钾、氯化钙等盐类能形成低共熔点混合物;与二氧化氮、膦、五氯化磷、二氧化硫、硫化氢、氰化氢等化合物起加成作用,并且产物都易分解。
3.稳定性[28] 稳定
4.禁配物[29] 易燃或可燃物、碱类、水、醇类
5.避免接触的条件[30] 潮湿空气
6.聚合危害[31] 不聚合
贮存方法
储存注意事项[32] 储存于阴凉、干燥、通风良好的库房。远离火种、热源。库温不超过30℃,相对湿度不超过75%。包装必须密封,切勿受潮。应与易(可)燃物、碱类、醇类等分开存放,切忌混储。不宜久存,以免变质。储区应备有合适的材料收容泄漏物。
合成方法
1.金属铝法 将铝锭放入密闭的氯化反应炉内,加热并通氯气进行氯化反应,生成的氯化铝升华进入捕集器,经捕集,即制得氯化铝成品。反应方程式如下:
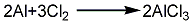
2.铝氧粉法 将一定粒度的工业氧化铝与石油焦按一定比例投入焙烧炉内混合均匀,由炉底通入空气进行焙烧。焙烧后的物料进入氯化炉,炉中通入氯气和氧气,铝氧粉在还原剂炭的存在下与氯反应。生成的气相产物经预冷、净化去捕集器,制得氯化铝成品。尾气经氢氧化钠或亚硫酸钠溶液吸收处理后排空。反应方程式如下:
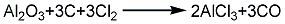
3.熔融法 将金属铝加热熔融后通入无水氯化氢,而制得。反应方程式如下:

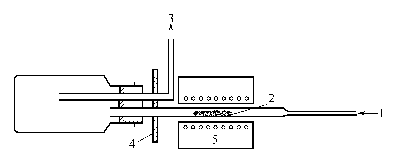
图XIII 16 氯化铝反应装置 1-氯化氢;2-铝粉;3-去通风橱;4-石棉;5-电炉
4.将直径为25~40mm的难熔燃烧管的一端延伸拉细。粗的一端通过软木塞插入广口瓶中(参阅图16)。软木塞开有另一孔,利用细玻璃管,使反应后产生的气体通过此细玻璃管排入通风橱中。在燃烧管中装有10~40g的铝粉。将燃烧管放进电炉中,用迅速流动的干燥氯化氢气将空气完全置换后,慢慢加热燃烧管直至产生白烟。此时,应注意勿使反应热将铝粉熔融成球状,达到某一温度时,大量的氯化铝升华至广口瓶中,直到铝反应完毕。在燃烧管全长中,非加热部分越短越好。否则,氯化铝就可能在这一部分凝固而使燃烧管堵塞。再者,为使装在广口瓶上的软木塞不被烧焦,有必要紧靠前面置以石棉。
5.将市售的氯化铝与质量约为其10%的铝屑充分混合。混合物放进升华管中,在升华过程中导入适量的干燥氯化氢气体。将粗而短的管与收集器烧瓶连接起来。连接干燥管的全系统应在防止湿气下保护起来。进一步精制时,可在氮气流中进行升华。
用途
1.本品主要用作有机合成及高分子合成的催化剂。广泛用于合成树脂、合成橡胶、石油裂解、合成染料、合成洗涤剂、医药、香料、农药等。本品还用作制取铝的有机化合物、金属的炼制及润滑油的处理。
2.用作有机合成的催化剂,如石油裂解、合成染料、合成橡胶、合成洗涤剂、医药、香料等。用于制造农药、有机铝化合物、酞菁系有机颜料用催化剂、乙基苯制造用催化剂。也用于金属冶炼、润滑油合成。食品级产品用作膨松剂、清酒等防变色剂及果胶的絮凝剂。
3.无水氯化铝可用作铝及合金蚀刻的添加剂,也可用于溶剂镀铝的铝盐添加。
4.三氯化铝是一个经典的路易斯酸,能够与底物中电负性较强的杂原子如氯原子、羰基氧等有效结合,从而起到活化底物的作用[1]。最经典的反应莫过于其诱导或催化的氯代烷烃或酰氯与芳烃之间的Friedel-Crafts烷基化和酰基化反应 (式1)[1]。

Friedel-Crafts反应还可以扩展到非芳环系统,如烯烃或炔烃等。代表性的例子有三氯化铝诱导的1,5-环辛二烯与酰氯作用发生的分子内成环反应 (式2)[2],以及α,β-不饱和酰氯在三氯化铝活化下与炔烃发生酰化反应,并进一步在还原剂锌的作用下生成环戊烯酮衍生物(式3)[3]。此外,三氯化铝还可以活化芳环α-甲基的C-H键,从而能够实现sp3-碳上的Friedel-Crafts反应。如3-甲基取代的吲哚在三氯化铝作用下发生酰化反应得到3-吲哚酮类化合物 (式4)[4]。
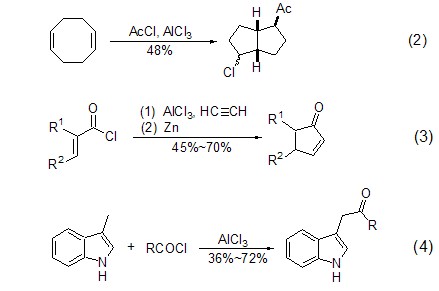
对于三甲基硅烷衍生物参与的Friedel- Crafts反应,不但可以提高反应的区域选择性,还能扩大底物的适用范围。因为三甲基硅取代基相比普通氢原子更大、更容易离去,因此它能有效地稳定β-位碳烯离子 (β-效应),从而能够完全地控制反应的区域选择性 (式5)[5]。此外,丙炔基硅烷在三氯化铝诱导下发生酰化反应能够得到联烯酮化合物 (式6)[6]。
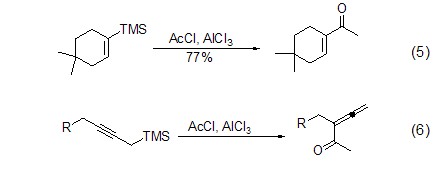
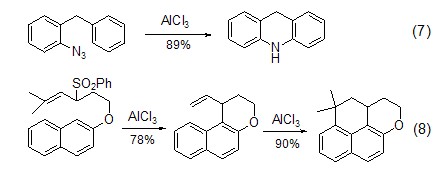
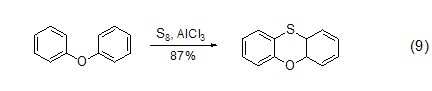
Friedel-Crafts反应不但可以将底物扩展到非芳环系统,还可以将三氯化铝活化的底物扩展到非卤代烃或酰氯的其它亲电试剂。如芳基叠氮化合物在三氯化铝作用下得到多环芳烃化合物 (式7)[7]。对于烯丙基砜类化合物,三氯化铝能够与砜有效作用从而活化烯丙基sp3-碳原子,进而与芳环发生亲电取代反应得到分子内关环产物 (式8)[8]。此外,三氯化铝还能活化单质硫,进而与二苯醚作用得到多环化合物 (式9)[9]。
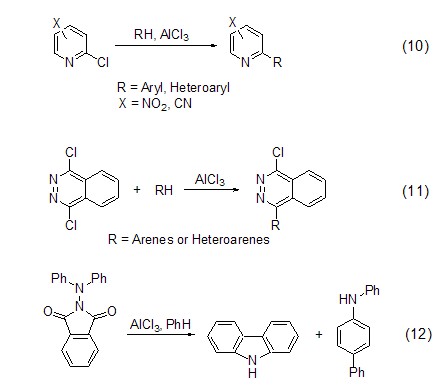
三氯化铝还能与氮原子有效作用,因此能够活化部分含氮底物,进而促进Friedel-Crafts反应的发生。如与带吸电子取代基的2-氯吡啶的氮原子 (式10)[10]或是与杂芳环上氮原子 (式11)[11] 作用从而活化邻位碳原子,进而与芳环或杂芳环发生亲电取代反应。三氯化铝还能与N-(N,N-二苯基氨)邻苯二甲酰亚胺中的羰基氧作用,通过电子转移得到二苯基铵阳离子中间体,进而发生分子内成环反应得到咔唑化合物 (式12)[12]。
作为路易斯酸,三氯化铝还能催化Diels-Alder反应,如苯基亚胺与二烯在AlCl3作用下得到含氮杂环化合物 (式13)[13]。此外,三氯化铝还被用于催化 [2+2] 环加成反应,如分子内烯炔成环反应 (式14)[14]。

5.用作有机合成中的催化剂,用于制备铝有机化合物以及金属的炼制。[33]
安全信息
危险运输编码:UN 1726 8/PG 2
危险品标志: 腐蚀
腐蚀
危险标识:R34
文献
1. (a) Zhao, Y.; Yang, Z.; Tang, L. Youji Huaxue, 2003, 23, 1219. (b) Thomas, C. A. Anhydrous Aluminum Chloride in Organic Chemistry, ACS Monograph Series; Reinholdt: New York, 1941. (c) Olah, G. A. Friedel-Crafts Chemistry, Wiley: New York, 1973. (d) Robberts, R. M.; Khalaf, A. A. Friedel-Crafts Alkylation Chemistry, Marcel Dekker: New York, 1984. 2. Cantrell, T. S. J. Org. Chem., 1967, 32, 1669. 3. (a) Martin, G. J.; Rabiller, C.; Mabon, G. Tetrahedron Lett., 1970, 3131. (b) Rizzo, C. J.; Dunlap, N. A.; Smith, A. B. J. Org. Chem., 1987, 52, 5280. 4. Pal, M.; Dakarapu, R.; Padakanti, S. J. Org. Chem., 2004, 69, 2913. 5. Eaborn, C. J. Chem. Soc., 1956, 4858. 6. Flood, T.; Peterson, P. E. J. Org. Chem., 1980, 45, 5006. 7. Takeuchi, H.; Maeda, M.; Mitani, M.; Koyama, K. Chem. Commun., 1985, 287. 8. Trost, B. M.; Ghadiri, M. R. J. Chem. Am. Soc., 1984, 106, 7260. 9. Ferrario, E. Bull. Soc. Chem. Fr., 1911, 9, 536. 10. Pal, M.; Batchu, V. R.; Dager, I.; Swamy, N. K.; Padakanti, S. J. Org. Chem., 2005, 70, 2376. 11. Pal, M.; Batchu, V. R.; Parasuraman, K.; Yeleswarapu, K. R. J. Org. Chem., 2003, 68, 6806. 12. Kikugawa, Y.; Aoki, Y.; Sakamoto, T. J. Org. Chem., 2001, 66, 8612. 13. Lecoz, L.; Wartski, L.; Seyden-Penne, J.; Chardin, P.; Nierlich, M. Tetrahedron Lett., 1989, 30, 2795. 14. Jung, M. E.; Haleweg, K. M. Tetrahedron Lett., 1981, 22, 2735. [1~14]参考书:现代有机bepaly tw <性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7 [15~33]参考书:危险beplay体育首页 安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号