| 物竞编号 | 0SV3 |
|---|---|
| 分子式 | C15H15N |
| 分子量 | 209.29 |
| 标签 | 2,3,3三甲基-4,5-苯并吲哚, 2,3,3-三甲基-4,5-苯并-3H-吲哚, 1,2,2’-三甲基-1H-苯基吲哚, 1,1,2-三甲基苯-1H-苯并[e]吲哚, 2,3,3-Trimethyl-4,5-benzo-3H-indole , 1,1,2-Trimethylnaphtho[1,2-d]pyrrole, TMBI, 碱性杂环中间体, 吲哚菁染料中间体, 光引发剂 |
编号系统
CAS号:41532-84-7
MDL号:MFCD00082627
EINECS号:255-429-8
RTECS号:暂无
BRN号:153709
PubChem号:24845416
物性数据
1. 性状:浅褐色粉末
2. 密度(g/mL,25ºC):0.7
3. 密度(g/cm3): 1.06
4. 熔点(ºC):111-117
5. 沸点(ºC,760mm hg):333.7
6. 沸点(ºC,20mm hg):未确定
7. 溶解性(20ºC):不溶于水
8. 闪点(ºC):147
9. 自燃点或引燃温度(ºC): 未确定
10. 蒸气压(kPa,25ºC):未确定
11. 饱和蒸气压(kPa,60ºC):未确定
12. 燃烧热(KJ/mol):未确定
13. 临界温度(ºC):未确定
14. 临界压力(KPa):未确定
15. 油水(辛醇/水)分配系数的对数值:未确定
16. 爆炸上限(%,V/V):未确定
17. 爆炸下限(%,V/V):未确定
毒理学数据
暂无
生态学数据
对水是稍微有危害的不要让未稀释或大量的产品接触地下水、水道或者污水系统,若无政府许可,勿将材料排入周围环境。
分子结构数据
1、 摩尔折射率:67.05
2、 摩尔体积(cm3/mol):195.9
3、 等张比容(90.2K):481.1
4、 表面张力(dyne/cm):36.3
5、 极化率(10-24cm3):26.58
计算化学数据
1.疏水参数计算参考值(XlogP):3.5
2.氢键供体数量:0
3.氢键受体数量:1
4.可旋转化学键数量:0
5.互变异构体数量:2
6.拓扑分子极性表面积12.4
7.重原子数量:16
8.表面电荷:0
9.复杂度:315
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
常规情况下不会分解,没有危险反应
贮存方法
储存于阴凉,低温的仓库内。远离火种,热源,防止阳光直射,保持容器密封。
合成方法
1.以β-萘肼与甲基异丙基酮为原料反应,得到2,3,3-三甲基-4,5-苯并吲哚,产率为82.2%,反应式为:
2.β-萘肼盐酸盐与甲基异丙基酮溶于定量的乙醇中,在80℃搅拌回流1.5h后,滴加硫酸脱水闭环,继续回流3.5h后,将混合物处理得粗产品,然后用环己烷重结晶,得产率为74%的2,3,3-三甲基-4,5-苯并吲哚。反应时间大大缩短,产率也较高。
3.β-萘酚代替可致癌且已被国际上禁用的2-萘胺原料,制得了2,3,3-三甲基-4,5-苯并吲哚。工艺过程简单,但反应时间较长,产率低(15%左右),因此值得有关研究者进一步对此合成方法进行探讨。反应如下:
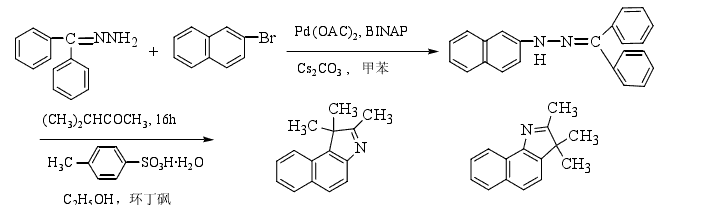
4.利用二芳基酮腙(Ar1Ar2C=NNH2)与2-卤代萘反应生成中间体二芳基酮-β-萘腙,然后加入甲基异丙基酮,在酸催化下脱水关环得2,3,3-三甲基-4,5-苯并吲哚。合成路线如下:
反应中没有使用易引起癌症的萘胺及萘肼,且产率较高(80%左右)。若用1-卤代萘与二芳基酮腙反应,在同样的条件下可得到化合物1的异构体2,3,3-三甲基-6,7-苯并吲哚。但此方法的反应时间长,使用的反应物较多,后处理较繁。
用途
1.可用作染料、医药中间体 是合成苯并吲哚菁染料的极为重要的碱性杂环中间体,也是合成多种光变染料的关键中间体,广泛用于花菁染料、电致发光材料、医药中间体。
2.含吲哚环的菁染料还可作为非线性光学材料、红外激光染料和计算机直接制版(CTP)的红外吸收剂等。
3.苯并吲哚菁染料是一类非常重要的有机功能染料,它与高新技术紧密结合,它的应用会越来越广。研究苯并吲哚菁染料的合成、结构、性质以及应用具有很高的学术价值和实用意义。
安全信息
危险运输编码:暂无
危险品标志: 刺激
刺激
危险标识:R36/37/38
文献
[1]K Y Law.Appl.Phyl.Lett.,1981,39(9):718~720. [2]V Petrov,C Rempel.Chem.Phys.Lett.,1988,148(1):26~28. [3]I Hidetsugu,S Toshio,K Kenji.Chem.Lett.,1991,7:1075~1078. [4]K Nagano,K Oikawa,F Masumi et al.JP:10 45,715,1998. [5]K Yamakawa,T Sato.EP:790,238,1997. [6]N Asanuma,A Suzuki,K Yamakawa.JP:128,863,2000. [7]F Sh Meng,J H Su,S J Yang et al.CN:1,312,249,2002. [8]S J Mason,S Balasubramanian.Org.Lett.,2002,4(24):4261~4264. [9]Y H Lin,R Weissleder,C H Tung.Bioconjugate Chem.,2002,13:605~610. [10]O Mader,K Reiner,H J Egelhaaf et al.Bioconjugate Chem.,2004,15:70~78. [11]N Narayanan,G Little,R Raghavenchari.SPIE Proc.,1995,2388:6. [12]L Tarazi,N Narayanan,J Sowell.Spectrochimica Acta,Part A,2002,58:257~264. [13]B Kopaindky,P Qiu.Appl.Phys.,1981,B29:15~18. [14]J Li,P Chen,X J Hu.Chinese Chem.Lett.,1996,7(12):1121~1124. [15]N Narayanan,G Patonay.J.Org.Chem.,1995,60:2391~2395. [16]Z R Zhang,S Achilefu.Org.Lett.,2004,6(12):2067-2070. [17]S Miltsov,C Encinas,J Alonso.Tetrahed.Lett.,1999,40:4067. [18]F Meadows,N Narayanan,G Patonay.Talanta,2000,50(6):1149~1155. [19]O V Przhonska,D J Hagan,E Novikov et al.Chem.Phys.,2001,273:235~248. [20]H Te,L Huang-chih,H Ting-ih et al.JP:226,606,2001. [21]W Y Liao,A T Hu,C L Huang et al.USP:2002,37,474,2002. [22]W Y Liao,M C Lee,C C Lee et al.Ger.Offen.DE:10,300,911,2004. [23]A S Waggoner,Z R Zhu,J Chao et al.Nucleic Acids Res.,1994,22(16):3418~3422.
备注
暂无

![1,1,2-三甲基苯并[e]吲哚结构式](http://staticv5.basechem.org/img/tupu/old/63a97bc39bb64920ae7518c5b5ffeeab.gif)
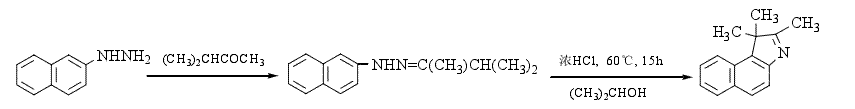
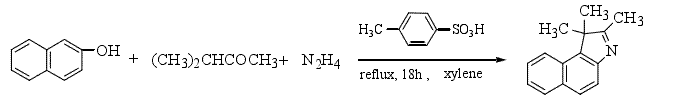



 沪公网安备 31010602001115号
沪公网安备 31010602001115号