| 物竞编号 | 0NFG |
|---|---|
| 分子式 | LiBH4 |
| 分子量 | 21.78 |
| 标签 | 四氢硼酸锂 |
编号系统
CAS号:16949-15-8
MDL号:MFCD00011088
EINECS号:241-021-7
RTECS号:ED2725000
BRN号:暂无
PubChem号:24882219
物性数据
1. 性状:白色晶体粉末
2. 密度(g/mL,25/4℃):0.68
3. 相对蒸汽密度(g/mL,空气=1):未确定
4. 熔点(ºC):268
5. 沸点(ºC,常压):66°C/760mmHg
6. 沸点(ºC,5.2kPa):未确定
7. 折射率:未确定
8. 闪点(ºC):-1
9. 比旋光度(º):未确定
10. 自燃点或引燃温度(ºC):未确定
11. 蒸气压(kPa,25ºC):未确定
12. 饱和蒸气压(kPa,60ºC):未确定
13. 燃烧热(KJ/mol):未确定
14. 临界温度(ºC):未确定
15. 临界压力(KPa):未确定
16. 油水(辛醇/水)分配系数的对数值:未确定
17. 爆炸上限(%,V/V):未确定
18. 爆炸下限(%,V/V):未确定
19. 溶解性:溶于水,溶于低级醇,在无水乙醇和异丙醇中放置无明显分解发生;还溶于醚、低级胺、二甘醇二甲醚,常常在这些醇和醚溶剂中使用。
毒理学数据
暂无
生态学数据
通常对水体是稍微有害的,不要将未稀释或大量产品接触地下水,水道或污水系统,未经政府许可勿将材料排入周围环境。
分子结构数据
暂无
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:1
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:2
8.表面电荷:0
9.复杂度:2
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:2
性质与稳定性
1.常温常压下稳定
避免的物料:水分/潮湿 酸 热 酸 碱 胺 卤素 氨
2.分解温度380℃。它在熔点温度下会缓慢地分解而放出氢气,但在低于熔点的温度下它是稳定的。它能溶解在正脂肪醚、环醚和多元醇醚中,并且同这些醚类生成醚合物(类似于卤化锂的性质)。
3.试剂的溶液、尤其是固体容易燃烧,固体还有可能会发生粉尘爆炸。建议在氮气的保护下隔绝水气保存,在通风橱中操作和使用。
贮存方法
常温密闭避光,通风干燥惰性气体下。
合成方法
1.第一个碱金属硼氢化物LiBH4是Schlessinger在1940年制备出来的,他们通过氢化锂和乙硼烷的反应合成了这个化合物。不过在工业上它总是通过硼氢化钠和氯化锂的交换反应来合成的。异丙胺是这个反应的最合适溶剂。除去了异丙胺之后用乙醚进行一次萃取,即得到产率为75%和纯度为97%~98%的硼氢化锂。
用途
硼氢化锂 (LiBH4) 是有机化学中最重要的还原剂之一,属于硼氢化合物家族的成员。锂的金属性比钠和钾弱,因而在有机溶剂中比NaBH4和KBH4 有较好的溶解度。硼氢化锂的还原能力比NaBH4和KBH4强,但是可以通过使用不同的溶剂来调控,次序大致为Et2O > THF > i-PrOH。加入锂盐或者叔胺可以增加它的反应速度,但NaBH4和KBH4没有这种效应。它的还原能力比LiAlH4弱,但具有较好的化学选择性。
该试剂基本完全覆盖了NaBH4和KBH4 的还原功能,甚至可以在低温下来完成。由于在低温下反应增加了试剂的可控性,因此LiBH4常常被用于一些具有特殊要求的羰基还原或者环氧还原[1~4]。例如:1,3-氨基醇或者1,3-羟基醚等 (式1,式2)[3,4]。

LiBH4与同类试剂最大的差异,或者说最重要的用途是将酯基还原成为相应的醇。虽然LiAlH4也可以完成该过程,但是LiBH4在酯基还原过程中具有非常好的选择性,羧酸、羧酸盐、氰基和N,N′-二取代酰胺均不受到影响 (式3,式4)[5~8]。
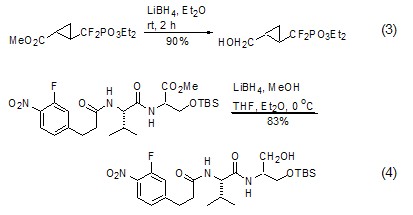
LiBH4 与环酰胺需要在溶剂中长时间回流才能将酰基部分还原为醇[9],但对二酰亚胺的还原却非常容易。如果使用手性环状酰胺作为辅助试剂与羧酸反应生成二酰亚胺结构,待完成手性辅助任务后,使用LiBH4不仅可以方便地切除辅助试剂,而且直接得到相应的醇 (式5,式6)[10~12]。

安全信息
危险运输编码:UN 3399 4.3/PG 1
危险品标志: 很易燃
很易燃  有毒
有毒  腐蚀
腐蚀
安全标识:S26 S43 S45 S36/S37/S39
危险标识:R11 R34 R20/21/22 R23/24/25 R14/15
文献
1. Lynch, J. E.; Choi, W.-B.; Churchill, H. R. O.; Volante, R. P.; Reamer, R. A.; Ball, R. G. J. Org. Chem., 1997, 62, 9223. 2. Bartoli, G.; Bellucci, M. C.; Bosco, M.; Dalpozzo, R.; Marcantoni, E.; Sambri, L. Tetrahedron Lett., 1999, 40, 2845. 3. Yoshimatsu, M; Naito, M; Shimizu, H; Muraoka, O; Tanabe, G; Kataoka, T. J. Org. Chem., 1996, 61, 8200. 4. Blaskovich, M. A.; Evindar, G.; Rose, N. G. W.; Wilkinson, S.; Luo, Y.; Lajoie, G. A. J. Org. Chem., 1998, 63, 3631. 5. Laib, T.; Zhu, J. Synlett, 2000, 1363. 6. Yokomatsu, T.; Abe, H.; Yamagishi, T.; Suemune, K.; Shibuya, S. J. Org. Chem., 1999, 64, 8413. 7. Bharathi, P.; Zhao, H.; Thayumanavan, S. Org. Lett., 2001, 3, 1961. 8. Liao, L.; Zhang, F.; Yan, N.; Golen, J. A.; Fox, J. M. Tetrahedron, 2004, 60, 1803. 9. Snider, B. B.; Ahn, Y.; O'Hare, S. M. Org. Lett., 2001, 3, 4217. 10. atsunaga, H.; Ishizuka, T.; Kunieda, T. Tetrahedron, 1997, 53, 1275. 11. Pilli, R. A.; Riatto, V. B.; Vencato, I. Org. Lett., 2000, 2, 53. 12. Wu, Y.; Shen, X.; Yang, Y.; Hu, Qi; Huang, J. J. Org. Chem., 2004, 69, 3857. 13.参考书:现代有机bepaly tw <性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号