| 物竞编号 | 0NF3 |
|---|---|
| 分子式 | NaBH4 |
| 分子量 | 37.83 |
| 标签 | Sodium tetrahydroborate, 钠硼氢, 发泡剂, 还原剂, 氢化剂, 处理剂 |
编号系统
CAS号:16940-66-2
MDL号:MFCD00003518
EINECS号:241-004-4
RTECS号:ED3325000
BRN号:暂无
PubChem号:24886165
物性数据
1. 性状:白色结晶粉末,易吸潮,遇火可燃。
2. 密度(g/mL,25/4℃):1.074
3. 相对蒸汽密度(g/mL,空气=1):1.074
4. 熔点(ºC):36~37
5. 闪点(ºC):69
6. 溶解性:水溶性550 g/L (25ºC)。溶于水、液氨、胺类,微溶于四氢呋喃,不溶于乙醚、苯、烃。
毒理学数据
小鼠口经LD50:160 mg/kg
生态学数据
通常对水体是稍微有害的,不要将未稀释或大量产品接触地下水,水道或污水系统,未经政府许可勿将材料排入周围环境。
分子结构数据
暂无
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:1
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:2
8.表面电荷:0
9.复杂度:2
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:2
性质与稳定性
1.常温常压下稳定
避免的物料:水分/潮湿 氧化物 酸 还原剂 氯化氢。在真空400 ℃时分解。有吸湿性,在干空气中稳定,在湿空气中分解。溶于水、液氨、胺类,微溶于四氢呋喃,不溶于乙醚、苯、烃。与水作用产生氢气。硼氢化钠碱性溶液呈棕黄色。
2.与硼氢化钠接触后有咽喉痛、咳嗽、呼吸急促、头痛、腹痛、腹泻、眩晕、眼结膜充血、疼痛等症状。
3.吸入或者皮肤接触该试剂对人体有害。试剂应干燥保存,使用时应特别小心,操作时在通风橱中进行。
贮存方法
1.应贮存在阴凉、干燥的库房中。
2.防潮,防震,勿与无机酸共贮混运,远离热源和火种及易燃物品。
合成方法
1. 氢化钠硼酸甲酯法 将硼酸和适量甲醇加入精馏釜中,徐徐加热,在54 ℃全回流2 h,然后收集硼酸甲酯与甲醇共沸液。共沸液经硫酸处理,精馏后可得较纯产物。将由氢气与钠作用而得的氢化钠送入缩合反应罐中,在搅拌下加热至220 ℃左右开始加硼酸甲酯,至260 ℃时停止加热;加料温度控制在280 ℃以下,加料后继续搅拌,使其充分反应。反应完成后冷却至100 ℃以下,离心分离,得缩合产物滤饼。在水解器中加入适量的水,将滤饼缓慢加入水解器中,控制温度在50 ℃以下,加料完毕后升温至80 ℃,离心分离,水解液则送入分层器中,静止1h后自动分层,下层水解液即为硼氢化钠溶液。其反应式如下:

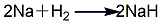
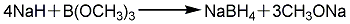
2. 硼氢化钠的生产可分为干法和湿法两类。干法是用无水硼砂和石英砂在高温下熔融反应生成硼硅酸钠,将后者粉碎后与金属钠和氢气,在450~500℃温度和(3.04~5.07)×105Pa压力下反应,生成硼氢化钠和硅酸钠。湿法是先用硼酸和甲醇反应合成硼酸三甲酯。将金属钠分散于石蜡油中,通氢气合成氢化钠。然后硼酸三甲酯和氢化钠在石蜡油介质中反应合成硼氢化钠。
一般工业上主要是用湿法生产硼氢化钠,整个工艺过程可分为四个步骤:
(1)酯化:在粗馏釜中加入化学计量的硼酸及甲醇,缓慢加热。在54℃回流2h之后,开始收集硼酸三甲酯与甲醇的共沸液,控制温度在54~55℃。超过55℃时停止收集。在56~69℃温度下回收甲醇。粗馏残液可回收硼酸。共沸液在酸洗槽中用硫酸脱醇,然后进行精馏,得到较纯的硼酸三甲酯。精馏后的残液回收硼酸三甲酯和甲醇。
(2)氢化:在氢化釜中放入石蜡油,经搅拌、静置后,在温度低于100℃时,将切成小块的金属钠投入石蜡油中,搅拌,升温。当温度升至200℃时,停止加热。通入氢气,与分散于石蜡油中的金属钠进行反应。反应温度应控制在300℃以下,温度若高于300℃,应向氢化釜中加入冷石蜡油调节。待反应完成后,停止通入氢气,金属钠基本上能全部转化成氢化钠。
(3)缩合:将氢化反应完成后的石蜡油料液送入缩合器中,开动搅拌。加热至220℃时。开始加入硼酸三甲酯,这时温度明显上升,当温度升至260℃时停止加热。加料进程中,温度不应超过280℃。硼酸三甲酯加完后,继续搅拌,使其充分反应。反应温度最好控制在275℃左右,反应完成后产率可达90%。将物料冷却至100℃以下,进行离心分离得到硼氢化钠滤饼。分离出的石蜡油可回收利用。
(4)水解:在水解器中加入计量的水,将上述硼氢化钠滤饼徐徐加入水解器中,加料时水温控制在50℃以下。加料完毕后温度升至80℃。因水解时甲醇钠分解成氢氧化钠和甲醇,溶液呈强碱性,水解温度稍高,硼氢化钠亦无明显分解。将此水解液离心分离,清液送入分层器中,静置1h后自动分层。下层水解液中含硼氢化钠和氢氧化钠,这种硼氢化钠碱性水溶液即可作为商品出售,其中硼氢化钠含量要求不低于5%。
若要制取固体NaBH4产品,可在硼氢化钠碱性水溶液中加入异丙胺(CH3)2CHNH2,在萃取器中将NaBH4萃取到有机相中。然后再在另一萃取器中用稀NaOH溶液反萃。异丙胺回收利用,碱液送去结晶。经过离心分离,得到NaBH4·2H2O结晶体,母液回收利用。湿晶体干燥之后得到NaBH4固体产品,其纯度不应低于97%。
硼氢化钠的分析是用碘量法间接滴定其中BH-4离子。在碱性试液中加入已知过量的KIO3溶液,硼氢阴离子被氧化为硼酸,然后加入KI,酸化试液。静置一定时间后,用Na2S2O3标准溶液滴定由过量碘酸钾所析出的碘。用途
1. 用作制造氢和硼氢化物。醛酮的还原。橡胶发泡剂。有机化合物中微量醛、酮、过氧化物的清除。
2. 是一种良好的还原剂,它的特点是性能稳定,还原时有选择性。可用作醛类、酮类和酰氯类的还原剂,塑料的发泡剂,制造双氢链霉素的氢化剂,制造硼氢化钾的中间体,合成硼烷的原料,以及用于造纸工业和含汞污水的处理剂等。硼氢化钠具有强还原性,用作化学镀镍、钴等的还原剂。
3. 硼氢化钠是一个温和且具化学选择性的还原试剂,属于硼氢化合物家族的成员,在含有羟基的溶剂 (如水、醇) 中,室温下能快速地将醛和酮还原;对羰基具有极强的还原性,作为还原剂广泛地应用于有机合成中;通过控制反应条件或选择不同的反应溶剂,可以实现对官能团的选择性还原。
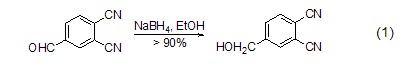
羰基化合物的还原 硼氢化钠能够还原包括醛、酮在内的很多类物质。如以乙醇为溶剂,硼氢化钠能够将醛类化合物还原为一级醇,该还原反应的产率很高,达到90%以上 (式1)[1,2]。
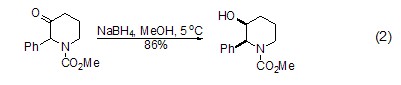
同样,在醇溶剂中,硼氢化钠也可将酮还原为二级醇 (式2)[3~5]。
由于它的强还原性,它可以还原酯等相对来说较难还原的物质,如利用胶束来实现酯的还原 (式3)[6]。酯的还原也可在醇等溶剂中实现[7,8]。
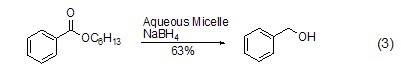
另外,硼氢化钠对酰胺键也具有还原作用(式4)[9],此反应的进行类似于多肽链的降解。
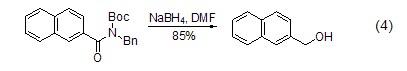
选择性还原 硼氢化钠虽然还原性较强,能够还原很多官能团,但是在某些条件下具有还原选择性。比如虽然它可以还原酮,但在一定情况下只与醛反应,将醛还原成醇,而同时存在的酮羰基不反应。利用硼氢化钠的这种选择性还原,可以进行很多有用的特殊合成。例如用硼氢化钠对酰胺基和酯基的选择性还原(式5)[10,11]。
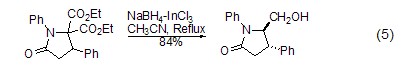
对双键、三键的还原 硼氢化钠除了可用在羰基化合物的还原上,也可对双键 (如碳-氮双键[12]) 或三键 (如炔烃[13]) 化合物进行还原。如在硼氢化钠的作用下,炔烃化合物还原为烯烃,还原得到的烯烃不会进一步被硼氢化钠还原 (式6)。
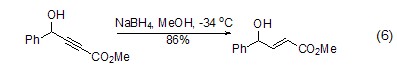
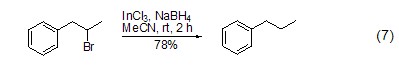
与卤代烃的反应 在过渡金属催化剂的存在下,硼氢化钠能够将卤代烃转化为烷烃 (式7)[14]。该反应可能经历了自由基过程,首先是InCl3在NaBH4作用下形成InCl2自由基,然后通过自由基取代的方式,将卤代烃转化为相应的烷烃。使用类似的方法,还可实现炔烃到烯烃的转化。
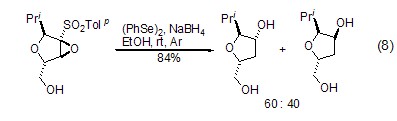
其它合成反应 硼氢化钠还可与有机硒化合物作用,在硒元素部位引入其它的基团 (如卤代甲基等,该卤代甲基可以进一步与其它试剂作用,从而使得分子存在多种衍生化方式)[15],或者通过有机硒的催化作用发生开环反应等 (式8)[16]。
安全信息
危险运输编码:暂无
危险品标志: 易燃
易燃  有毒
有毒  有害
有害  腐蚀
腐蚀
安全标识:S22 S26 S43 S45 S36/S37/S39
文献
1. Guldi, D. M.; Gouloumis, A.; Vázquez, P.; Torres, T.; Georgakilas, V.; Prato, M. J. Am. Chem. Soc., 2005, 127, 5811. 2. Zhong, G. F. Angew. Chem., Int. Ed., 2003, 42, 4247. 3. Kise, N.; Ohya, K.; Arimoto, K.; Yamashita, Y.; Hirano, Y.; Ono, T.; Ueda, N. J. Org. Chem., 2004, 69, 7710. 4. Correa, N. M.; Zorzan, D. H.; D′Anteo, L.; Lasta, E.; Chiarini, M.; Cerichelli, G. J. Org. Chem., 2004, 69, 8231. 5. Correa, N. M.; Zorzan, D. H.; Chiarini, M.; Cerichelli, G. J. Org. Chem., 2004, 69, 8224. 6. Das, D.; Roy, S.; Das, P. K. Org. Lett., 2004, 6, 4133. 7. Kwon, S. J.; Ko, S. Y. J. Org. Chem., 2001, 66, 6833. 8. Luo, W.; Yu, Q.-S.; Holloway, H. W.; Parrish, D.; Greig, N. H.; Brossi, A. J. Org. Chem., 2005, 70, 6171. 9. Ragnarsson, U.; Grehn, L.; Maia, H. L. S.; Monteiro, L. S. Org. Lett., 2001, 3, 2021. 10. Haldar, P.; Ray, J. K. Org. Lett., 2005, 7, 4341. 11. Leban, J. J.; Colson, K. L. J. Org. Chem., 1996, 61, 228. 12. Mori, S.; Shin, J.-Y.; Shimizu, S.; Ishikawa, F.; Furuta, H.; Osuka, A. Chem. Eur. J., 2005, 11, 2417. 13. Meta, C. T.; Koide, K. Org. Lett., 2004, 6, 1785. 14. Hayashi, N.; Shibata, I.; Baba, A. Org. Lett., 2004, 6, 4981. 15. Qin, Y.-Y.; Qiu, X.-L.; Yang, Y.-Y.; Meng, W.-D.; Qing, F.-L. J. Org. Chem., 2005, 70, 9040. 16. Fernandez de la Pradilla, R.; Alhambra, C.; Castellanos, A.; Fernandez, J.; Manzano, P.; Montero, C.; Urena, M.; Viso, A. J. Org. Chem., 2005, 70, 10693. 17.参考书:现代有机bepaly tw <性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号