| 物竞编号 | 0RTC |
|---|---|
| 分子式 | C3H8IN |
| 分子量 | 185.01 |
| 标签 | 二甲基亚甲基碘化铵, n,n-二甲基亚甲基碘化胺, (N,N-二甲基), N,N-二甲基亚甲基碘化铵, Eschenmoser's Salt, Dimethyl methylene ammonium Iodide, Dimethyl methyleneimmonium iodide, N,N-Dimethylmethyleneammonium Iodide, N,N-Dimethylmethyleneiminium Iodide, Dimethyl Methyleneammonium Iodide~Eschenmosers Iodide Salt, (N,N-Dimethyl)Methyleneammoniumiodi |
编号系统
CAS号:33797-51-2
MDL号:MFCD00011810
EINECS号:251-680-2
RTECS号:暂无
BRN号:1731022
PubChem号:24865478
物性数据
1. 性状:浅黄色固体
2. 密度(g/mL,20℃):未确定
3. 相对蒸汽密度(g/mL,空气=1):未确定
4. 熔点(ºC):240
5. 沸点(ºC,常压):未确定
6. 沸点(ºC,KPa):未确定
7. 折射率:未确定
8. 闪点(ºC):未确定
9. 比旋光度(º):未确定
10. 自燃点或引燃温度(ºC):未确定
11. 蒸气压(Pa,20ºC):未确定
12. 饱和蒸气压(KPa,20ºC):未确定
13. 燃烧热(KJ/mol):未确定
14. 临界温度(ºC):未确定
15. 临界压力(KPa):未确定
16. 油水(辛醇/水)分配系数的对数值:未确定
17. 爆炸上限(%,V/V):未确定
18. 爆炸下限(%,V/V):未确定
19. 溶解性:溶于DMF,稍溶于MeOH、THF、MeCN和CH2Cl2,但是溶解度不影响该试剂在这些溶剂中的使用。
毒理学数据
暂无
生态学数据
通常对水是稍微有危害的,若无政府许可,勿将材料排入周围环境。
分子结构数据
暂无
计算化学数据
1、 疏水参数计算参考值(XlogP):
2、 氢键供体数量:0
3、 氢键受体数量:1
4、 可旋转化学键数量:0
5、 互变异构体数量:
6、 拓扑分子极性表面积(TPSA):3
7、 重原子数量:5
8、 表面电荷:0
9、 复杂度:26.3
10、同位素原子数量:0
11、确定原子立构中心数量:0
12、不确定原子立构中心数量:0
13、确定化学键立构中心数量:0
14、不确定化学键立构中心数量:0
15、共价键单元数量:2
性质与稳定性
1.如果遵照规格使用和储存则不会分解,未有已知危险反应。
2.避免氧化物、水分等。
3.具有较强的吸湿性,对湿气非常敏感,试剂瓶需要用石蜡封口。
贮存方法
密封、在2 ºC -8 ºC下保存
合成方法
1. 将三甲胺、二碘甲烷、二氧六环和无水乙醇的混合物置暗处在室温反应100h,滤集生成的晶体,依次用乙醇和乙醚洗涤,在70℃真空干燥,得到碘甲基三甲基碘化铵。将其和环丁砜一起加热,至160℃保持12min,滤集析出的晶体,用四氯化碳洗涤,在50℃真空干燥,得成品。
2. 制二甲基亚甲基碘化铵在装有搅拌器、温度计、氮气导入管、与冷阱相连的导出管的干燥四颈烧瓶中,加入40.0克(0 .122摩尔)碘甲基三甲基碘化铁和120毫升环丁讽(用前先后经过氢氧化钙、氢化钙蒸馏)。通氮气冲洗,在搅拌和缓慢注入氮气流下,置油浴中加热至160℃,约12分钟。升温130℃时晶体迅速溶解,碘甲烷被氮气流带入冷阱。冷却,从黄色溶液中析出晶体,氮气氛中吸滤晶体,用四氯化碘洗涤五次至近无色,在高真空下50℃干燥,得到二甲基亚甲基碘化按18 .4克(81%)。
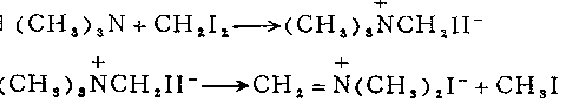
3. 在装有电磁搅拌棒、橡皮帽、氮气导入管的干燥25。毫升三颈烧瓶中,加入现制备的32.8克(0.164摩尔)碘化三甲硅溶于20毫升无水乙醚的溶液。在0℃下加入1毫升2一甲基一2一丁烯以除去碘化三甲硅水解产生的碘化氢,并滴加16.8i克(0.164摩尔)N,N,N’,N‘,一四甲基亚甲二胺溶寸:20毫升无水乙醚的溶·液。立即生成白色沉淀,继续搅拌20分钟。吸滤,用无水乙醚洗涤(3份每份75毫升),空气干燥,立即入真空于燥器贮存。得产品29.1克96%)。如果需要,可以减压升华或从环丁飒中重结晶。
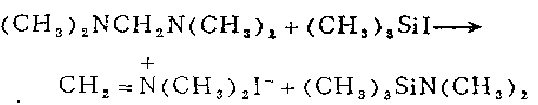
用途
1. 用作高反应性的Mannich试剂。与格氏试剂、乙烯基锂、苯硫酚钠及稳定的负碳离子加成。将甲基引入可碄核(Corrin nucleus)内醋亚甲化。
2. Eschenmoser盐在有机合成中被定义为Mannich反应中甲醛和二甲胺的替代物。由于Mannich反应是一个可逆反应,所以许多时候直接使用甲醛和二甲胺发生的反应具有产率低的缺点。Eschenmoser盐实际上是甲醛和二甲胺生成的亚胺盐,不仅使用操作比较方便,而且具有更高的反应活性。
Eschenmoser盐在Mannich反应中与能够形成碳负离子的底物分子发生亲电胺甲基化反应,在底物分子中引入N,N-二甲氨基甲基片段。被醛、酮羰基或者酯基致活的亚甲基或者次甲基均可以发生该反应,生成β-二甲氨基醛、酮或者酯 (式1)[2]。该试剂与带有推电子基取代的芳香碳环或者富电子的芳香杂环化合物的胺甲基化反应非常容易[3,4]。吲哚或者吡唑衍生物可以在非常温和的条件下给出几乎定量的产率 (式2,式3)[5,6]。

该试剂最重要的应用价值是在有机合成中作为一碳合成子,与醛和酮羰基、酯基致活的亚甲基或者次甲基发生反应生成α-取代的丙烯醛、酮或者酯。实质上,该反应产物是Mannich反应前期产物β-二甲氨基醛、酮或者酯进一步发生二甲胺消去反应形成的最终产物。所以,只需提高Mannich反应的温度和延长Mannich反应的时间即可得到理想的产物。环酮和内酯在该反应中生成相应的环外双键具有特别重要的意义 (式4,式5)[7,8]。

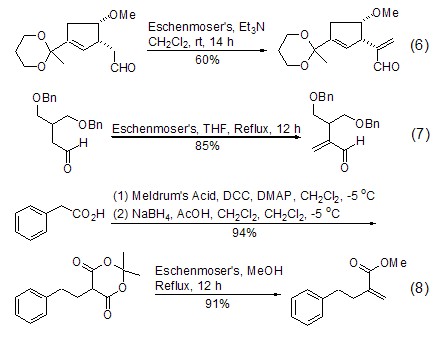
由于Eschenmoser盐可以在非常温和的条件下制备具有重要合成价值的α-取代的丙烯醛和丙烯酸酯,所以在天然产物的合成中得到了广泛的应用。生成α-取代的丙烯醛的反应大多情况下是将底物与Eschenmoser盐在CH2Cl2中搅拌数小时即可。加入三乙胺或者升高反应的温度可以达到增加反应速度的效果 (式6,式7)[9~11]。首先将羧酸与Meldrum’s酸缩合生成单烷基化的Meldrum’s酸衍生物,然后再与Eschenmoser盐在甲醇中回流,则构成了一条获得α-取代丙烯酸酯的方便途径 (式8)[12]。
安全信息
危险运输编码:暂无
危险品标志: 刺激
刺激
危险标识:R36/37/38
文献
1. Bryson, T. A.; Bonitz, G. H.; Reichel, C. J.; Dardis, R. E. J. Org. Chem., 1980, 45, 524. 2. Langlois, N.; Le Nguyen, B. K. J. Org. Chem., 2004, 69, 7558. 3. Wang, Z.; Huynh, H. K.; Han, B.; Krishnamurthy, R.; Eschenmoser, A. Org. Lett., 2003, 5, 2067. 4. Bream, R. N.; Ley, S. V.; Procopiou, P. A. Org. Lett., 2002, 4, 3793. 5. Cai, X.; Snieckus, V. Org. Lett., 2004, 6, 2293. 6. Fan, D.; Taniguchi, M.; Yao, Z.; Dhanalekshmi, S.; Lindsey, J. S. Tetrahedron, 2005, 61, 10291. 7. Shing, T. K. M.; Lee, C. M.; Lo, H. Y. Tetrahedron, 2004, 60, 9179. 8. Mihelcic, J.; Moeller, K. D. J. Am. Chem. Soc., 2004, 126, 9106. 9. Zhao, L.; Burnell, D. J. Org. Lett., 2006, 8, 155. 10. Smith, A. B., III; Sfouggatakis, C.; Gotchev, D. B.; Shirakami, S.; Bauer, D.; Zhu, W.; Doughty, V. A. Org. Lett., 2004, 6, 3637. 11. Wang, J.; Hsung, R. P.; Ghosh, S. K. Org. Lett., 2004, 6, 1939. 12. Hin, B.; Majer, P.; Tsukamoto, T. J. Org. Chem., 2002, 67, 7365. 13.参考书:现代有机bepaly tw <性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无








 沪公网安备 31010602001115号
沪公网安备 31010602001115号