| 物竞编号 | 0PHQ |
|---|---|
| 分子式 | RuO4 |
| 分子量 | 165.07 |
| 标签 | 氧化剂 |
编号系统
CAS号:20427-56-9
MDL号:暂无
EINECS号:243-813-8
RTECS号:暂无
BRN号:暂无
PubChem号:暂无
物性数据
1.溶解性:极易溶于氯仿和四氯化碳,微溶于水。它具有两种形态,其中黄色四氧化钌mp 25.5 oC,bp 40 oC;橙色四氧化钌mp 27 oC,bp 108 oC。
毒理学数据
暂无
生态学数据
暂无
分子结构数据
暂无
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:4
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积68.3
7.重原子数量:5
8.表面电荷:0
9.复杂度:138
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
四氧化钌是一个非常危险的试剂,能够与滤纸和醇发生爆炸性反应,与醚、苯和吡啶的反应也非常剧烈。它能够很容易地氧化人体内组织,留下二氧化钌沉积,它的蒸气能强烈刺激眼睛和呼吸道,因此使用时一定要避免吸入。但是,当反应中只存在催化剂量的四氧化钌时,上述危险性能大大降低。
贮存方法
合成方法
1. 将粉末状金属钌进行碱熔制成钌酸钾K2RuO4,用水溶解为水溶液,在80~90℃下通氯气,则发生反应。生成的RuO4气化出来,在冰水中冷却的接受槽里以固体形式被收集起来。根据这个反应,完全可以与其他铂族元素(Os除外)分离。要制备超纯产品时,用三个接受槽:前两个槽加10%氢氧化钾水溶液,最后一个槽再加少量甲醇(0.1%左右)。收集在三个接受槽中并被槽中溶液吸收的K2RuO4作为原料溶液,像前述那样通Cl2将RuO4蒸馏出来。若混有锇时,也生成挥发性OsO4,难以分离开来。这时,可在碱熔后用水溶解,以硝酸酸化使成酸性,煮沸除锇,放冷后使成碱性,像前述那样处理。
2. 将0.4克二氧化钌悬浮于50毫升四氯化碳中。加入3.2克偏过碘酸钠溶于50毫升水的溶液,在0℃搅拌1小时。黑色的二氧化钌渐渐地溶解。分出清亮的黄色四氯化碳溶液,经过玻璃毛过滤以除去不溶物。将溶液放在分液漏斗中,加入新鲜的偏过碘酸钠(1.0克/50毫升)。摇荡混合物,直到四氯化碳溶液呈持久的黄色。在冷处贮放。用RuCl3与稍过量的偏过碘酸钠水溶液和四氯化碳在室温搅拌过夜,也可制得RuO4。
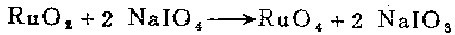
3. 四氧化钌有固体形式,也有稳定的水溶液形式。可以通过RuO2或RuCl3与强氧化试剂反应而原位制备而来。
用途
四氧化钌是一个对多种官能团非常有效的氧化试剂,能够实现诸如双键、芳环或二醇断裂等官能团转换反应。
四氧化钌催化剂等价于催化剂量的RuCl3或RuO2加上定量的共氧化剂组成的催化体系。通常采用的共氧化剂有次氯酸钠、溴酸钠、过乙酸、高碘酸、高碘酸钠、氧气。硫酸铈、高锰酸钾以及过硫酸氢钾等。研究表明,四氧化钌催化的反应中水的存在发挥着非常重要的促进作用,因而通常反应都是在混合溶剂如CCl4-H2O中进行。
四氧化钌催化氧化反应一个非常重要的特点是能保证与反应位点邻近的立体中心的立体化学保持不变 (式1)[1]。
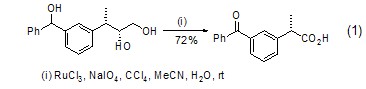
四氧化钌催化的醇类化合物的氧化反应在有机合成上具有非常重要的意义。RuCl3或RuO2在强氧化剂如高碘酸钠作用下能够将一级醇转换为羧酸 (式2)[2],在分子氧、次氯酸钙的作用下则将其氧化为醛 (式3)[3]。
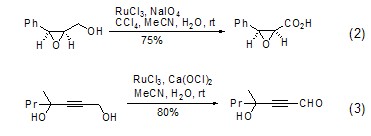
对于特殊底物如环丁醇的氧化反应,四氧化钌相对于其它氧化剂如高锰酸钾等能够获得最高的产率 (式4)[4]。
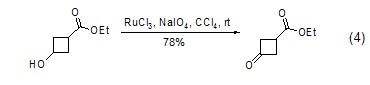
四氧化钌还能将醛催化氧化为羧酸,将芳香烃转变为醌以及将硫化物转变为砜 (式5)[5]。类似的,四氧化钌还能氧化杂原子如氧、氮的邻位亚甲基,如将甲基醚转换为甲基酯的反应 (式6)[6]。
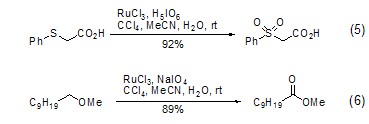
四氧化钌还能将醛催化氧化为羧酸,将芳香烃转变为醌以及将硫化物转变为砜 (式5)[5]。类似的,四氧化钌还能氧化杂原子如氧、氮的邻位亚甲基,如将甲基醚转换为甲基酯的反应 (式6)[6]。
在四氧化钌催化实现的官能团氧化反应中,还可能伴随底物其它基团的断裂反应,如将环己基苯转变为环己基甲酸的反应 (式7)[7],或是将萘转变为二羧酸的反应 (式8)[8],反应底物都发生了部分断裂。
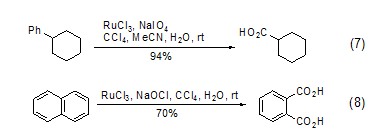
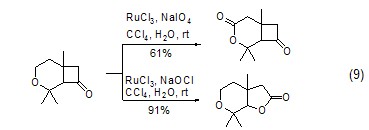
四氧化钌的氧化活性能够通过多种方式来调节,最简单的就是采用不同氧化活性的氧化试剂与低价钌反应获得不同活性的高价钌试剂。如在高碘酸钠作用下,三氯化钌能够实现醚邻位亚甲基的氧化,而在次氯酸钠作用下,则能实现环酮的Baeyer-Villiger反应 (式9)[9]。
调节四氧化钌氧化活性的另一种方法是加入配体。电负性配体的引入可以增大金属中心的碱性,从而改善其氧化能力。如加入联吡啶配体bpy,可以实现二苯乙烯的环氧化反应 (式10)[10]。在碱的作用下,可以实现二苯乙烯的酮羟基化反应 (式11)[11]。在酸性条件下可以实现烯烃的双羟基化反应 (式12)[12]。
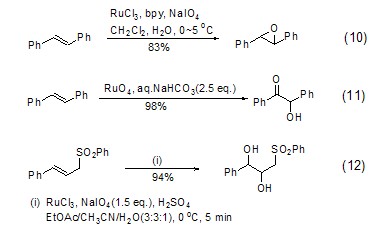
调节四氧化钌氧化活性的另一种方法是加入配体。电负性配体的引入可以增大金属中心的碱性,从而改善其氧化能力。如加入联吡啶配体bpy,可以实现二苯乙烯的环氧化反应 (式10)[10]。在碱的作用下,可以实现二苯乙烯的酮羟基化反应 (式11)[11]。在酸性条件下可以实现烯烃的双羟基化反应 (式12)[12]。
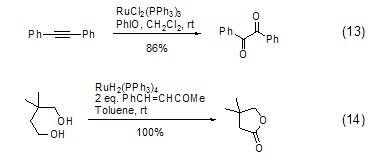
另外,采用其它钌金属试剂前体也可以实现其它类型的氧化反应。如采用三苯基膦二氯化钌RuCl2(PPh3)3与亚碘酰苯组合能够将炔转变为二酮 (式13)[13],或是采用RuH2(PPh3)4与氢受体如亚苄基丙酮组合能够将二醇转变为内酯 (式14)[14]。
安全信息
危险运输编码:UN3139
危险品标志:暂无
安全标识:S16 S17 S36/S37/S39
危险标识:暂无
文献
1. (a) Trost, B. M.; Toste, F. D.; Pinkerton, A. B. Chem. Rev., 2001, 101, 2067. (b) Kasai, M.; Ziffer, H. J. Org. Chem., 1983, 48, 712. 2. Carlsen, P. H. J.; Katsuki, T.; Martin, V. S.; Sharpless. K. B. J. Org. Chem., 1981, 46, 3936. 3. Griffith, W. P.; Ley, S. V.; Whitcombe, G. P.; White, A. D.Chem. Commun., 1987, 1625. 4. Cqputo, J. A.; Fuchs, R. Tetrahedron. Lett., 1967, 4729. 5. Rodriguez, C. M.; Ode, J. M.; Palazon, J. M.; Martin, V. S. Tetrahedron, 1992, 48, 3571. 6. Morris, P. E.; Jr.; Kiely, D. E. J. Org. Chem., 1987, 52, 1149. 7. Spitzer, U. A.; Lee, D. G. J. Org. Chem., 1974, 39, 2468. 8. Nunez, M. T.; Martin, V. S. J. Org. Chem., 1990, 55, 1928. 9. Johnston, B. D.; Slessor, K. N.; Oehlschlager, A. C. J. Org. Chem., 1985, 50, 114. 10. Balavoine, G.; Eskenazi, C.; Meunier, F.; Riviere, H. Tetrahedron Lett., 1984, 25, 3187. 11. (a) Plietker, B. J. Org. Chem., 2003, 68, 7123. (b) Plietker, B. J. Org. Chem., 2003, 68, 7123. 12. Plietker, B.; Niggemann, M. Org. Lett., 2003, 5, 3353. 13. Ishii, Y.; Osakada, K.; Ikariya, T.; Saburi, M.; Yoshikawa, S. J. Org. Chem., 1986, 51, 2034. 14. Murahashi, S.; Naota, T.; Ito, K.; Maeda, Y.; Taki, H. J. Org. Chem., 1987, 52, 4319. 15.参考书:现代有机bepaly tw <性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号