| 物竞编号 | 0K6Z |
|---|---|
| 分子式 | CuBr2 |
| 分子量 | 223.35 |
| 标签 | 二溴化铜, 溴化铜, 溴化銅, 二溴化銅, 溴化酮, copperbromide(cubr2), copperdibromide, Cupric Bromide, Copper(II) bromide, Copperic bromide , Copper(Ⅱ) bromide, 高纯度化合物, 催化剂 |
编号系统
CAS号:7789-45-9
MDL号:MFCD00010970
EINECS号:232-167-2
RTECS号:暂无
BRN号:暂无
PubChem号:24882065
物性数据
1. 性状:黑色单斜晶系结晶,有潮解性。
2. 密度(g/mL 25ºC):4.71
3. 相对蒸汽密度(g/mL,空气=1):未确定
4. 熔点(ºC):498
5. 沸点(ºC,常压):900
6. 沸点(ºC,5.2kPa):未确定
7. 折射率(n20/D):未确定
8. 闪点(ºC,):900
9. 比旋光度(º):未确定
10. 自燃点或引燃温度(ºC):未确定
11. 蒸气压(kPa,25ºC):未确定
12. 饱和蒸气压(kPa,60ºC):未确定
13. 燃烧热(KJ/mol):未确定
14. 临界温度(ºC):未确定
15. 临界压力(KPa):未确定
16. 油水(辛醇/水)分配系数的对数值(25℃):未确定
17. 爆炸上限(%,V/V):未确定
18. 爆炸下限(%,V/V):未确定
19. 溶解性(mg/mL):极易溶于水,溶于乙醇、丙酮、吡啶、氨,不溶于苯。
毒理学数据
1、急性毒性:
LD50:4000mg/Kg(大鼠经口);4720mg/Kg(兔经皮)。
LC50:9400mg/m3,2小时(小鼠吸入)。
生态学数据
对水是稍微危害的,若无政府许可,勿将材料排入周围环境。
分子结构数据
暂无
计算化学数据
暂无
性质与稳定性
1.如果遵照规格使用和储存则不会分解。
2.避免接触水分/潮湿,氧化物,碱金属.溶于丙酮、乙醇及吡啶而成绿色溶液。将溴化铜加热则分解为溴化亚铜和溴。
3.具有吸湿性。
贮存方法
必须干燥保存。
合成方法
1. 按反应式计量的氧化铜溶于热的(避免煮沸)氢溴酸中,经玻璃过滤器过滤后,立即将滤液置于硫酸上进行真空浓缩,使目标产物固化。
用途
溴化铜可以作为溴化试剂、氧化试剂和路易斯酸试剂。
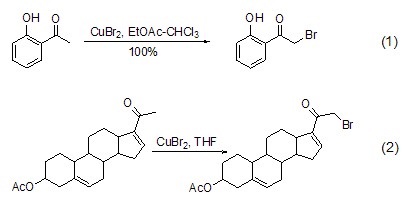
溴化铜是一个有效的溴化试剂,能作用于多种官能团化合物。如实现羰基邻位亚甲基的溴化反应 (式1)[1]。当底物中存在其它亚甲基,如甾体化合物时,溴化铜能识别羰基的位置,从而选择性地实现羰基邻位的溴化反应 (式2)[2]。
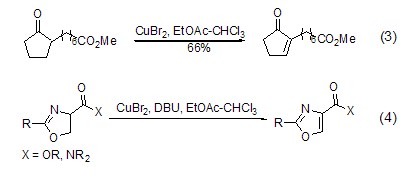
溴化铜也能实现二酮化合物的α-溴化反应,进而再发生消除反应实现“一锅法”引入羰基双键 (式3)[3]。4-羰基唑啉在溴化铜和DBU作用下也能转换为相应的共轭化合物(式4)[4]。
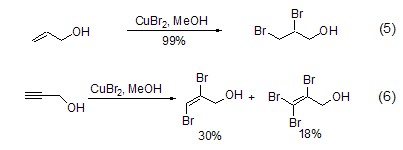
在甲醇中,溴化铜还能实现非芳香环的烯烃和炔烃的二溴代或三溴代反应。如将烯丙醇转换为1,2-二溴-3-羟基丙烷 (式5),或者将丙炔醇转换为反式二溴烯丙醇或三溴烯丙醇 (式6)[5]。
溴化铜也能实现芳香环系统的溴化反应,如在四氯化碳中能高产率地实现蒽到9-溴代蒽的转换 (式7)[6]。当蒽的9-位被卤素、烷基、芳基占据时,能够得到10-位溴化产物。反应对其它芳环系统同样使用,如实现3-吡咯羧酸酯的溴化反应得到4-溴吡咯衍生物 (式8)。

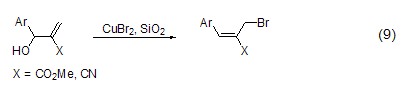
溴化铜也能实现烯丙醇的溴化反应,如在硅胶支持下区域选择性实现3-羟基-2-亚甲基丙酸酯或3-羟基-2-亚甲基丙腈的溴化反应 (式9)[7]。若没有硅胶存在,则该反应不会发生。当吸附在其它试剂如氧化铝、氧化镁或氧化钛上时,则发生很多副反应。
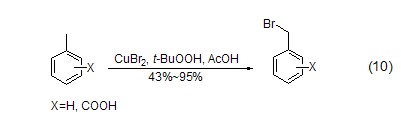
此外,溴化铜与叔丁基过氧化氢t-BuOOH结合,在乙酸或酸酐溶剂中还能实现苄基的溴化反应 (式10)[8]。虽然这种方法的产率相比用NBS的方法要低,但是它没有溶解度的问题,能实现在有机溶剂中不溶解的底物的溴化反应。
溴化铜还能参与共轭加成反应,如格氏试剂对α,β-不饱和酯的1,4-加成反应在催化量的溴化铜和HMPA存在下能够得到促进 (式11)[9],而溴化铜不会被格氏试剂还原。

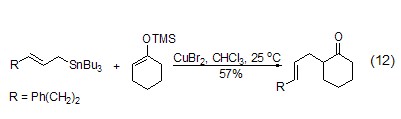
溴化铜作为一个高价铜试剂,也能用于氧化反应,如氧化烯丙基锡试剂与硅基烯醇醚的碳-碳键形成反应 (式12)[10]。
安全信息
危险运输编码:UN 3260 8/PG 3
危险品标志: 腐蚀
腐蚀
安全标识:S26 S45 S36/S37/S39
文献
1. Bauer, D. P.; Macomber, R. S. J. Org. Chem., 1975, 40, 1990. 2. Glazier, E. R. J. Org. Chem., 1962, 27, 4397. 3. Miller, D. D.; Moorthy, K. B.; Hamada, A. Tetrahedron Lett., 1983, 24, 555. 4. Barrish, J. C.; Singh, J.; Spergel, S. H.; Han, W.-C.; Kissick, T. P.; Kronenthal, D. R.; Mueller, R. H. J. Org. Chem., 1993, 58, 4494. 5. Castro. C. E.; Gaughan, E. J.; Owsley, D. C. J. Org. Chem., 1965, 30, 587. 6. Mosnaim, D.; Nonhebel, D. C. Tetrahedron, 1969, 25, 1591. 7. Gruiec, A.; Foucaud, A.; Moinet, C. New. J. Chem., 1991, 15, 943. 8. Chaintreau, A.; Adrian, G.; Couturier, D. Synth. Commun., 1981, 11, 669. 9. Sakata, H.; Aoki, Y.; Kuwajima, I. Tetrahedron Lett., 1990, 31, 1161. 10. Takeda, T.; Ogawa, S.; Koyama, M.; Kato, T.; Fujiwara, T. Chem. Lett., 1989, 1257. 11.参考书:现代有机bepaly tw <性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号