| 物竞编号 | 0K7P |
|---|---|
| 分子式 | NaIO4 |
| 分子量 | 213.89 |
| 标签 | Sodium metaperiodate, 过碘酸钠;偏高碘酸钠, 氧化剂 |
编号系统
CAS号:7790-28-5
MDL号:MFCD00003534
EINECS号:232-197-6
RTECS号:SD4550000
BRN号:暂无
PubChem号:24855134
物性数据
1.性状:无色结晶或白色晶状粉末[9]
2.熔点(℃):300(分解)[10]
3.相对密度(水=1):3.87[11]
4.溶解性:易溶于水、乙酸、盐酸、硫酸、硝酸,不溶于乙醇。[12]
毒理学数据
1.急性毒性[13] LD50:58mg/kg(小鼠腹腔)
2.刺激性 暂无资料
生态学数据
1.生态毒性 暂无资料
2.生物降解性 暂无资料
3.非生物降解性 暂无资料
分子结构数据
1、摩尔折射率:无可用的
2、摩尔体积(cm3/mol):无可用的
3、等张比容(90.2K):无可用的
4、表面张力(dyne/cm):无可用的
5、介电常数:无可用的
6、极化率:无可用的
7、单一同位素质量:213.873888 Da
8、标称质量:214 Da
9、平均质量:213.8918 Da
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:4
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积74.3
7.重原子数量:6
8.表面电荷:0
9.复杂度:118
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:2
性质与稳定性
1.具有强烈的氧化性能,本身虽不燃烧,但在一定的条件下,经受摩擦、震动撞击、高热或遇酸碱的物质,在受潮,接触有机物、还原剂以及和性质有抵触的物品混存时,即能分解,发生燃烧和爆炸。
2.稳定性[14] 稳定
3.禁配物[15] 易燃或可燃物、活性金属粉末、镁硫、磷、强还原剂
4.避免接触的条件[16] 受热
5.聚合危害[17] 不聚合
贮存方法
储存注意事项[18] 储存于阴凉、通风的库房。远离火种、热源。库温不超过30℃,相对湿度不超过80%。避免光照。包装密封。应与易(可)燃物、活性金属粉末等分开存放,切忌混储。储区应备有合适的材料收容泄漏物。
合成方法
1.氯气氧化法 将碘在水介质中,通入氯气进行氧化生成高碘酸,经分离杂质后,加入氢氧化钠溶液中和至Ph2~3,生成高碘酸钠溶液,再经提纯、分离杂质、蒸发浓缩、冷却结晶、离心分离、干燥,制得高碘酸钠成品,其反应方程式如下:

2.用Na3H2IO6与HNO3反应制取。向100g Na3H2IO6中加200mL水和55mL浓HNO3(过量20%)。如果液体不是澄清透明的,就用磨砂漏斗过滤。将滤液蒸发到开始结晶,然后冷却到20℃。滤出沉淀,用冷水洗涤后在110℃干燥。产量61g,产率84%。
3.采用氯气氧化法 在碱性介质中通入氯气,将碘氧化成高碘酸二氢二钠沉淀,再加硝酸酸化,经浓缩得成品。在氢氧化钠溶液中,通入氯气使碘氧化,生成正高碘酸二氢三钠,其反应式如下:
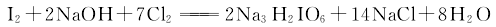
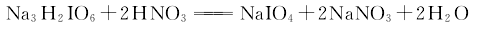
利用NaIO4与NaNO3在水中溶解度的差别,浓缩析出NaIO4结晶,重结晶后可得成品。流程如下: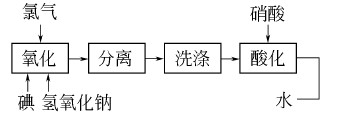
4.在碘和水的混合物中通入氯气将碘氧化成高碘酸,除去杂质后,加入氢氧化钠进行反应至PH=2~3:
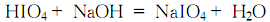
反应结束后过滤,滤液用水浴蒸发浓缩至结晶析出,静置冷却使结晶完全,快速过滤后,用水洗涤结晶至合格,甩干后于110℃干燥,得高碘酸钠。
用途
1.用于陶瓷片纸、印花布、印片纸等丝网印花的制版工艺;在印刷版制造过程中,用于从印刷版底层除去不溶的聚乙烯醇层。
2.医药工业的重要原料,亦用作普通分析试剂及色谱分析试剂。
3.高碘酸钠在有机合成中主要有两种用途:一方面被用作氧化剂;另一方面被用作催化剂。高碘酸钠的氧化反应在水中发生,但是对有机物来说,其不溶于水,因而要用助溶剂。当两相溶液中有由季铵盐或季盐组成的相转移催化剂,或者氧化剂的表面有惰性载体时,氧化反应也可以发生。
高碘酸钠作为一般的氧化剂可以把醇类氧化为羰基化合物 (式1,式2)[1,2]。
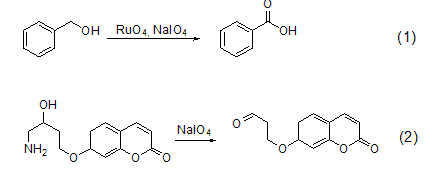
高碘酸钠也可以用于断裂二醇化合物并把其氧化为二羰基化合物 (式3,式4)[3,4]。

高碘酸钠甚至把C=C双键断裂氧化为羰基化合物 (式5)[5],它和OsO4连用氧化烯烃称为著名的Lemieux-Johnson试剂 (式6)[6]。另外,它的还原产物可以通过高碘酸氧化而重新使用。
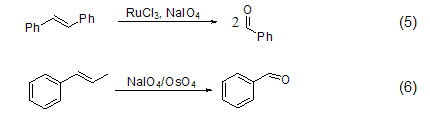
硫化物选择性地氧化成亚砜是一个非常重要的反应,因为亚砜是一个在有机合成中非常重要的中间物。它可以在0 oC的甲醇溶液中与高碘酸钠发生反应。高温或加入过量的高碘酸钠会将硫化物氧化成砜。当有酸性氧化铝或是硅胶时,高碘酸钠可选择性地将硫化物氧化成亚砜 (室温条件下可以得到很高的产率) (式7,式8)[7]。相转移催化剂的参与也使硫化物选择性地氧化生成亚砜 (式9)[8]。
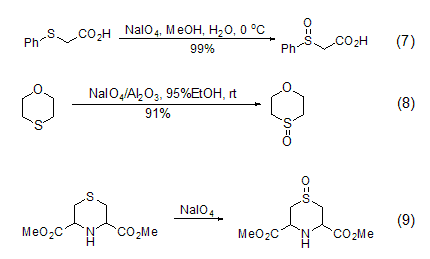
此外,高碘酸钠可以作为一种廉价的催化剂用于芳基的磺酰化合成 (式10),反应条件非常温和,产率高,反应时间短,选择性好。
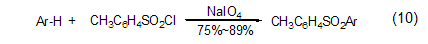
4.用作分析试剂和氧化剂。[19]
安全信息
危险运输编码:UN 3087 5.1/PG 2
危险品标志: 氧化剂
氧化剂  有害
有害
安全标识:S17 S26 S36/S37/S39
危险标识:R8 R22 R20/21/22 R36/37/38
文献
1. Cornely, J.; Leyda M.; David E.; Dragojlovic. V. Green Chem., 2003, 5, 34. 2. Badalassi, F.; Wahler, D.; Cortti, P.; Reymond, J-L. Angew. Chem. Int. Ed., 2000, 39, 4067. 3. (a) Kovar, J; Baer, H. H. Can. J. Chem., 1971, 49, 3238. (b) Torii, S; Uneyama, K; Ueda, K. J. Org. Chem., 1984, 49, 1930. (c) Schmid, C. R; Bryant, J. D; Dowlatzedah, M; Phillips, J. L; Prather, D. E; Renee, D. S; Sear, N. L; Vianco, C. S. J. Org. Chem., 1991, 56, 4056. (d) Jackson, D. Y. Synth. Commun., 1988, 18, 337. 4. Painter, G. F.; Falshaw, A. Org. Biomol. Chem., 2004, 2, 1007. 5. Plietker, B.; Niggemann, M.; Pollrich , A. Org. Biomol. Chem., 2004, 2, 1116. 6. Sinha, A.K.; Joshi, B. P. Chem. Lett., 2003, 32, 780. 7. (a) Leonard, N. J; Johnson, C. R. J. Org. Chem., 1962, 27, 283. (b) Johnson, C. R; Keiser, J. E. Org. Synth., 1966, 46, 78. (c) Lee, J. B; Yergatian, S. Y; Crowther, B. C; Downie, I. M. Org. Prep. Proced. Int., 1990, 22, 544. 8. Hutton, A.; Jaber, R.; Otaegui, M.; Turner, J. J. Chem. Soc., Perkin Trans. II, 2002, 1066. [1~8]参考书:现代有机bepaly tw <性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7 [9~19]参考书:危险beplay体育首页 安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无





 沪公网安备 31010602001115号
沪公网安备 31010602001115号