| 物竞编号 | 0KPZ |
|---|---|
| 分子式 | RuCl3 |
| 分子量 | 207.43 |
| 标签 | 暂无 |
编号系统
CAS号:10049-08-8
MDL号:MFCD00011208
EINECS号:233-167-5
RTECS号:VM2650000
BRN号:暂无
PubChem号:24852520
物性数据
1. 性状:有光泽的黑色板状结晶。
2. 密度(g/mL,25℃):3.11
3. 相对蒸汽密度(g/mL,空气=1):未确定
4. 熔点(ºC):500
5. 沸点(ºC,常压):717
6. 沸点(ºC,5.2kPa):未确定
7. 折射率:未确定
8. 闪点(ºC):未确定
9. 比旋光度(º):未确定
10. 自燃点或引燃温度(ºC):未确定
11. 蒸气压(kPa,20ºC):未确定
12. 饱和蒸气压(kPa,60ºC):未确定
13. 燃烧热(KJ/mol):未确定
14. 临界温度(ºC):未确定
15. 临界压力(KPa):未确定
16. 油水(辛醇/水)分配系数的对数值:未确定
17. 爆炸上限(%,V/V):未确定
18. 爆炸下限(%,V/V):未确定
19. 溶解性:α-RuCl3为黑色有光泽晶体,不溶于醇、水;β-RuCl3为棕黑色蓬松晶体,溶于醇、水。
毒理学数据
1、急性毒性:大鼠腹腔LD50:280mg/kg;
生态学数据
通常对水是不危害的,若无政府许可,勿将材料排入周围环境。
分子结构数据
1、摩尔折射率:无可用的
2、摩尔体积(cm3/mol):无可用的
3、等张比容(90.2K):无可用的
4、表面张力(dyne/cm):无可用的
5、介电常数:无可用的
6、极化率(10-24cm3):无可用的
7、单一同位素质量:206.810946 Da
8、标称质量:207 Da
9、平均质量:207.429 Da
计算化学数据
1、 疏水参数计算参考值(XlogP):未确定
2、 氢键供体数量:0
3、 氢键受体数量:3
4、 可旋转化学键数量:0
5、 拓扑分子极性表面积(TPSA):0
6、 重原子数量:4
7、 表面电荷:0
8、 复杂度: 0
9、 同位素原子数量:0
10、 确定原子立构中心数量:0
11、 不确定原子立构中心数量:0
12、 确定化学键立构中心数量:0
13、 不确定化学键立构中心数量:0
14、 共价键单元数量:4
性质与稳定性
1.磁化率χm约为2300×10-6emu(电磁单位)(293K),在低温时具有强的反磁性。不溶于水及乙醇。
β-型为棕色固体,相对密度3.11,高于500℃温度下分解,不溶于水,溶于乙醇。β-型在氯气中加热至700℃,转变为α型,而α-型向β-型转变的温度为450℃。β-RuCl3能使非极性溶剂着色,但溶解度甚低。
2.四氧化钌是一个非常危险的试剂,能够与滤纸和醇发生爆炸性反应,与醚、苯和吡啶的反应也非常剧烈。它能够很容易地氧化人体内组织,留下二氧化钌沉积,它的蒸气能强烈刺激眼睛和呼吸道,因此使用时一定要避免吸入。但是,当反应中只存在催化剂量的四氧化钌时,上述危险性能大大降低。
3.无水三氯化钌极易吸水,因此必须在惰性气体保护下称量操作,置于干燥通风处保存。
贮存方法
合成方法
1.α-RuCl3(1)在硼硅酸耐热玻璃反应管中,往0.25~3g金属钌粉上通入氯气和一氧化碳的混合气(Cl2∶CO=3∶1,体积比),在600℃下加热12h,产物用乙醇洗涤以除去约0.2%的Ru2OCl6,接着在氯气流中于600℃下加热3h。(2)先合成β-RuCl2,然后在氯气或氩气流中加热(氩气中450℃下加热8h,氯气中650℃下2h)。(3)在硼硅酸耐热玻璃反应管中,放入2g合成的β-RuCl3,并在氯气流中于650℃下加热。在此温度下,痕量的Ru2OCl6(紫色)将升华。以后在730℃下α-RuCl3升华,在与Ru2OCl6分离后析出结晶。
2.β-RuCl3在硼硅酸耐热玻璃反应管中,放入海绵状金属钌0.5g,通入氯气与一氧化碳混合气体(Cl2∶CO=3∶1)(体积比),同时在330~340℃时加热4~6h。将生成物轻轻压碎,再在混合气体中于330~340℃下加热6~8h,然后冷却。在加热至反应温度或在冷却时,宜在氯气流中进行。本法制得的产物中,测不出未反应的钌,但其中α-RuCl3的含量约为1%~2%(根据测定其磁化率的推算值)。
用途
1.用作光谱纯试剂。
2.三氯化钌是一个温和的路易斯酸,能够有效活化烯烃、炔烃,实现其相应的官能化转移反应。此外,三氯化钌与氧化剂如O2组成的氧化体系还能实现多种官能团的有氧氧化转移反应。
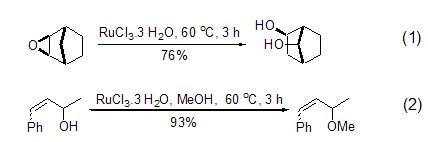
三氯化钌是一个有效的路易斯酸试剂,由于钌金属本身的亲氧性,因此可以活化含氧化合物的C-O键,实现底物骨架的重排反应 (式1)[1]。在醇的存在下,三氯化钌能够实现烯丙基醇到烯丙基醚的转换 (式2)[2]。
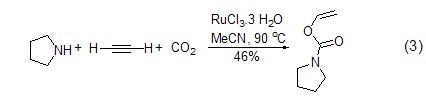
三氯化钌能够有效活化炔烃的C-H键,从而实现炔烃的官能团转换反应。如在乙腈中催化实现四氢吡喃、乙炔和CO2的三组分加成反应 (式3)[3]。
与其它路易斯酸金属试剂组合,三氯化钌能够有效实现水相中的多组分反应,如与三氯化铟InCl3组成的诱导体系,能够催化实现醛与炔烃的水相加成反应 (式4)[4]。其中,三氯化钌用于活化炔烃,而InCl3则用于活化醛基。

同样的,三氯化钌与溴化亚铜组成的双金属催化剂RuCl3/CuBr,也能在水相中实现苯胺、醛和末端炔的三组分加成反应 (式5)[5]。CuBr用于活化醛与苯胺生成的亚胺中间体,进而插入到钌-炔烃键中实现三组分的加成。
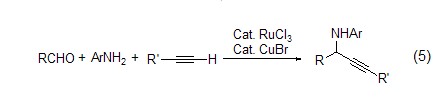
除了活化较活泼的炔烃外,三氯化钌还能活化特殊烯烃,如α-甲基苯乙烯 (式6)[6]。研究推测活化的机理:首先发生Ru-Cl对烯烃的加成反应,进而通过β-H消除反应得到真正的催化前体Ru-H试剂,进而实现烯烃的二聚反应。

在乙醇溶剂中,三氯化钌也能活化呋喃的2-位C-H键,进而实现邻位二聚或三聚偶联反应 (式7)[7]。

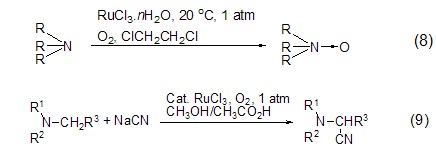
在氧气存在下,三氯化钌能催化实现胺类化合物的氧化官能团转换反应,如在二氯乙烷中实现三级胺的有氧氧化,高产率地得到N-氧化物 (式8)[8]。在氰化钠NaCN存在下,三氯化钌能在醇类溶剂中实现三级胺的氧化氰化反应 (式9)[9]。
除了氧气外,其它氧化剂也能与三氯化钌组合实现特殊的官能团转换反应。如在定量N-甲基吗啉存在下,三氯化钌能将醇类化合物氧化为醛 (式10)[10];在过硫酸氢钾制剂存在下,三氯化钌则能催化实现二苯乙烯的氧化断裂反应,高产率地得到苯甲醛 (式11)[11]。
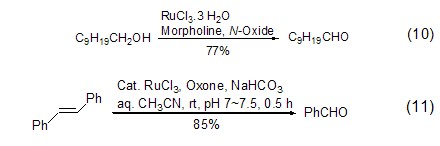
安全信息
危险运输编码:暂无
危险品标志:暂无
安全标识:暂无
危险标识:暂无
文献
1. (a) Trost, B. M.; Toste, F. D.; Pinkerton, A. B. Chem. Rev., 2001, 101, 2067. (b)Tenaglia, A.; Terranova, E.; Waegell, B. Tetrahedron. Lett., 1991, 32, 1169. 2. Ito, S.; Matsumoto, M. Synth. Commun., 1982, 12, 807. 3. Sasaki, Y.; Dixneuf, P. H. J. Org. Chem., 1987, 52, 314. 4. (a) Li, C.-J.; Wang, D.; Chen, D. L. J. Am. Chem. Soc., 1995, 117, 12867.(b)Wei, C. M.; Li, C.-J. Green Chem., 2002, 39. 5. Li, C.-J.; Wei, C. M. Chem. Commun., 2002, 268. 6. Higashimura, M.; Imamura, K.; Yokogawa, Y.; Sakakibara, T. Chem. Lett., 2004, 33, 728. 7. Jaouhari, R.; Guenot, P.; Dixneuf, P. H. Chem. Commun., 1986, 1255. 8. Jain, S. L.; Sain, B. Chem. Commun., 2002, 1040. 9. Murahashi, S.; Komiya, N.; Terai, H.; Nakae, T. J. Am. Chem. Soc., 2003, 125, 15312. 10. Sharpless, K. B.; Akashi, K.; Oshima, K. Tetrahedron. Lett., 1976, 2503. 11. Yang, D.; Zhang, C. J. Org. Chem., 2001, 66, 4814 12.参考书:现代有机bepaly tw <性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号