| 物竞编号 | 02ZL |
|---|---|
| 分子式 | C4H9Li |
| 分子量 | 64.05 |
| 标签 | 正丁基锂, 太阳能电池beplay体育首页 |
编号系统
CAS号:109-72-8
MDL号:MFCD00009414
EINECS号:203-698-7
RTECS号:暂无
BRN号:1209227
PubChem号:24858234
物性数据
1.性状:无色至黄色透明液体,接触空气发生燃烧。[15]
2.熔点(℃):-76[16]
3.沸点(℃):80~90(0.0133Pa)[17]
4.闪点(℃):-12[18]
5.溶解性:不溶于水,溶于戊烷、己烷、环己烷、苯、醚类、烃。[19]
毒理学数据
1.急性毒性 暂无资料
2.刺激性 暂无资料
生态学数据
1.生态毒性 暂无资料
2.生物降解性 暂无资料
3.非生物降解性 暂无资料
分子结构数据
暂无
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:1
4.可旋转化学键数量:1
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:5
8.表面电荷:0
9.复杂度:7.6
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:2
性质与稳定性
1.正丁基锂溶液暴露于空气或湿气时易起火。对正丁基锂的操作应在与水蒸气和O2隔离后进行,并穿戴好护目镜、防腐手套等安全装备。一旦着火,应用干粉灭火器扑灭,千万不可使用含水或氯代烷烃的灭火器。正丁基锂参与的反应应在隔绝空气和湿气的氮气或氩气保护下,使用时一定要小心谨慎。
2.稳定性[20] 稳定
3.禁配物[21] 酸类、醇类、水、空气、卤素类和胺类
4.避免接触的条件[22] 潮湿空气
5.聚合危害[23] 不聚合
6.分解产物[24] 氧化锂
贮存方法
储存注意事项[25] 储存于阴凉、干燥、通风良好的专用库房内,远离火种、热源。库温不超过30℃,相对湿度不超过80%。包装必须密封,切勿受潮。应与酸类、醇类等分开存放,切忌混储。不宜大量储存或久存。采用防爆型照明、通风设施。禁止使用易产生火花的机械设备和工具。储区应备有泄漏应急处理设备和合适的收容材料。
合成方法
1.可以通过氯代正丁烷或溴代正丁烷与金属锂在乙醚或烃类溶剂中反应制备而来。
用途
1.用于制备各种烷基、芳基衍生物的有机金属化合物,是生产太阳能电池的原料。
2.是重要的锂试剂。与卤代烷和有机化合物中的活性氢交换而将铿原子引入其中,继而可进行许多反应。也用作聚合反应引发剂。
3.正丁基锂作为一个强碱,能够作为含活泼氢底物的锂化试剂,也能用于锂-卤交换反应或锂-金属转移金属化反应[1]。
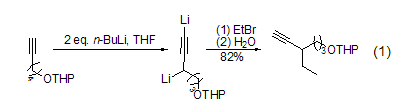
作为异丁基锂和叔丁基锂的同类物质,正丁基锂的碱性和反应活性都较差一些,但对于含活泼氢的底物,却是一个有效的脱质子试剂,特别是当形成的是杂原子阴离子或形成的碳阴离子能够被共轭效应稳定(如阴离子在sp碳上)时。因而,多种含氧、氮、磷的有机底物,以及茚、三苯甲烷、乙烯基苯或甲基杂芳环化合物(如吡啶、喹啉等)等含苯基的底物,能够很容易与正丁基锂反应形成锂盐。典型的如丙二烯依据不同的取代基位置及取代烷基空间大小的不同在C-1或C-3位发生的锂化反应,或端炔在丁基锂作用下生成炔基锂的反应都很容易实现。丙炔氢也很容易被正丁基锂夺取,当端炔与两当量的正丁基锂反应时会在丙炔基和端炔位发生双锂化反应 (式1)[2]。
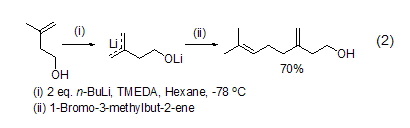
正丁基锂的金属化活性在给电子溶剂如THF或乙醚中要比在普通烃类溶剂中强,这是因为给电子溶剂能够与缺电子的锂发生配位,进而促进低阶有机锂的聚集。而在普通烃类溶剂中,正丁基锂会形成高阶聚集。通常正丁基锂都是在配体存在下使用的,如加入N,N,N′, N′-四甲基乙二胺 (N,N, N′, N′-Tetramethylethylenedi- amine, TMEDA) 或1,4-二氮杂二环[2.2.2]辛烷 (1,4-diazabicyclo[2.2.2]octane, DABCO) 都能活化正丁基锂进而促进锂化反应,如原本惰性的苯在这些添加物存在下也能与正丁基锂作用发生锂化或多锂化反应。烯丙基化合物或苯基α-位不含活化基团的苄基苯也能在活化配体存在下与正丁基锂反应 (式2)[3]。
金属醇化物也可以作为添加剂起到活化正丁基锂的作用,如添加叔丁基钾后的混合试剂n-BuLi/t-BuOK能够实现芳基炔的双金属化反应,进而被亲电试剂进攻得到邻取代芳基炔化合物 (式3)[4]。

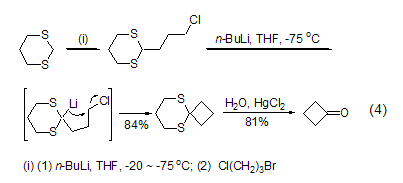
含杂原子如氧、硫、氮的化合物能够与正丁基锂反应能够选择性得到α-脱质子产物。如1,3-二硫化合物能发生两次α-位锂化反应,揭示了1,3-二硫化合物作为保护基团的用途 (式4)[5]。
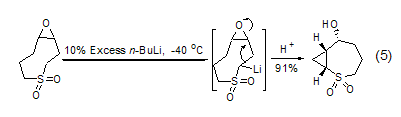
当在足够低的温度 (如–78 oC)下 反应时,α-位脱质子过程要比同分子存在亲电中心的亲核加成反应快,这是控制正丁基锂反应的一条重要策略。如先控制较低温度发生锂化反应,然后升温发生对新形成C-Li键的分子内亲核加成反应 (式5)[6]。
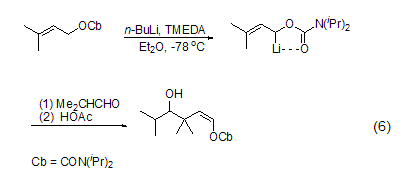
当底物含有能与Li配位的杂原子如羰基氧时,杂原子邻位的氢很容易被脱除发生锂化反应,这是因为形成了“偶极稳定”的碳阴离子。如2-烯基-N,N-二烷基氨基甲酸酯在–78 oC及正丁基锂/TMEDA的作用下发生快速的α-脱质子反应,得到的偶极稳定的碳阴离子再与酮或醛作用就能高立体选择性地形成γ-羟基烷基烯醇醚 (式6)[7]。
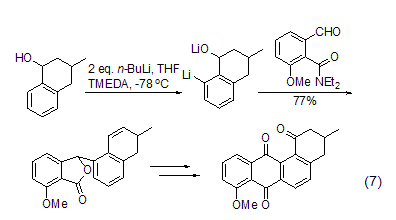
含杂原子取代基的芳香化合物与正丁基锂作用会选择性地发生邻位锂化反应,如NR2、CH2NR2、CH2CH2NR2、OMe、C=NR、SO2NR2等基团都能促使芳香环上的邻位锂化反应,这种邻位锂化反应在合成上具有非常重要的用途 (式7)[8]。
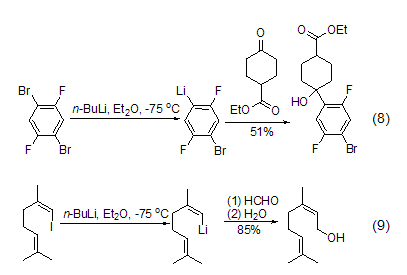
正丁基锂的另一类重要反应是与卤代有机底物发生锂-卤交换反应,这是在有机合成上非常重要的一种获得有机锂化合物的方法,特别是对芳基锂、乙烯基锂和环丙基锂的合成非常有用。与卤素取代基发生交换反应的活性按I > Br > Cl > F递减,对于含氟取代基的芳香烃基本上不会与正丁基锂发生反应 (式8)[9]。而对于碘化物,则很容易与正丁基锂作用发生锂卤交换,进而与醛或酮等亲电试剂反应得到加成产物 (式9)。
除了锂卤交换反应外,正丁基锂还很容易与其它含锡、硒、碲或汞的有机金属试剂发生作用,发生转移金属化反应。反应通常在低温和醚类溶剂中进行。其中,锡-锂交换反应在合成上最为重要,可用于合成芳基和乙烯基锂化合物 (式10,式11)[10,11]。

包括苄基、乙烯基、炔基和烷氧基锂在内的许多有机锂试剂也可以通过Li-Te交换反应而来 (式12)[12]。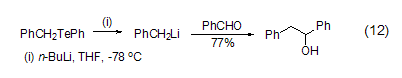
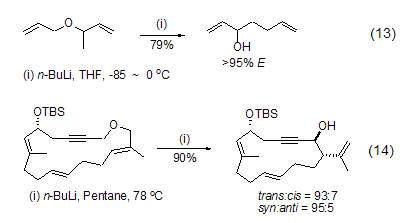
正丁基锂也经常用于阴离子重排反应。如烯丙基醚或丙炔基醚在正丁基锂作用下发生2,3-Wittig重排。反应通常先在低温下通过α-脱质子反应或Li-Sn交换反应得到阴离子,然后再升温发生分子内重排 (式13,式14)[13,14]。
4.用作聚合催化剂、烃化剂、火箭燃料等。[26]
安全信息
危险运输编码:UN 3399 4.3/PG 1
危险品标志: 易燃
易燃  腐蚀
腐蚀  危害环境
危害环境
安全标识:S6 S9 S16 S26 S45 S61 S62 S36/S37/S39
危险标识:R11 R34 R65 R67 R14/15 R50/53
文献
1. (a) Mugesh, G.; Singh, H. B. Acc. Chem. Res., 2002, 35, 226. (b) Wakefield, B. J. The Chemistry of Organolithium Com- pounds, Pergamon: Oxford, 1974. (c) Wakefield, B. J. Organolithium Methods; Academic: San Diego, 1990. (d)Wardell, L. J. In Comperhensive Organometallic Chemistry, Wilkinson, G., Ed.; Pergamon: Oxford, 1982. Chapetr 2. 2. Takashi, K.; Konishi, K.; Ushio, M.; Takaki, M.; asami, R. J. Organometa. Chem., 1973, 50, 1. 3. Akiyama, S.; Hooz, J. Tetrahedron Lett., 1973, 41, 15. 4. Hommes, H.; Verkruijsse, H. D.; Brandsma, L. Tetrahedron Lett., 1981, 22, 2495. 5. Seebach, D.; Beck, A. K. Org. Synth., Coll. Vol., 1988, 6, 316. 6. Cere, V,: Paolucci, C.; Pollicino, S.; Sandri, E.; Fava, A. J. Org. Chem., 1991, 56, 4513. 7. Meyers, A. I.; Edwards, P. D.; Rieker, W. F.; Bailey, T. R. J. Am. Chem. Soc., 1984, 106, 3270. 8. (a) Slocum, D. W.; Jennings, C. A. J. Org. Chem., 1976, 41, 3653. (b) Turner, J. A. J. Org. Chem., 1983, 48, 3401. 9. Kitatani, K.; Hiyama, T.; Nizaki, H. J. Am. Chem. Soc., 1975, 97, 949. 10. Sawyer, J. S.; Macdonald, T. L; McGarvery, G. J. J. Am. Chem. Soc., 1984, 106, 3376. 11. Broka, C. A.; Shen, T. J. Am. Chem. Soc., 1989, 111, 2981. 12. Tomoki, H.; Kambe, N.; Ogawa, A.; Miyoshi, N.; Murai, S.; Sonoda, N. Angew. Chem. Ed. Int. Engl., 1987, 26, 1187 . 13. Nakai, T.; Mikami, K.; Taya.; S.; Fujira, Y. J. Am. Chem. Soc., 1981, 103, 6492. 14. (a) Marshall, J. A.; Robinson, E. D.; Lebreton, J. J. Org. Chem., 1990, 55, 227. (b) Takashi, T.; Nemoto, H.; Kanda, Yanda, Y.; Tsuji, J.; Fujise, Y. J. Org. Chem.,1986, 51, 4315. [1~14]参考书:现代有机bepaly tw <性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7 [15~26]参考书:危险beplay体育首页 安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无





 沪公网安备 31010602001115号
沪公网安备 31010602001115号