| 物竞编号 | 01EV |
|---|---|
| 分子式 | C3H6O |
| 分子量 | 58.08 |
| 标签 | 2-丙酮, 阿西通, 二甲基甲酮, 醋酮, Dimethyl ketone, Methyl acetyl, 2-Propanone, Dimethyl ketone, β-Ketopropane, Pyroacetic ether |
编号系统
CAS号:67-64-1
MDL号:MFCD00008765
EINECS号:200-662-2
RTECS号:AL3150000
BRN号:635680
PubChem号:24883758
物性数据
1.性状:无色透明易流动液体,有芳香气味,极易挥发。[1]
2.熔点(℃):-95[2]
3.沸点(℃):56.5[3]
4.相对密度(水=1):0.80[4]
5.相对蒸气密度(空气=1):2.00[5]
6.饱和蒸气压(kPa):24(20℃)[6]
7.燃烧热(kJ/mol):-1788.7[7]
8.临界温度(℃):235.5[8]
9.临界压力(MPa):4.72[9]
10.辛醇/水分配系数:-0.24[10]
11.闪点(℃):-18(CC);-9.4(OC)[11]
12.引燃温度(℃):465[12]
13.爆炸上限(%):13.0[13]
14.爆炸下限(%):2.2[14]
15.溶解性:与水混溶,可混溶于乙醇、乙醚、氯仿、油类、烃类等多数有机溶剂。[15]
16.折射率(n20ºC):1.3589
17.折射率(n25ºC):1.3560
18.黏度(mPa·s,25ºC):0.316
19.比旋光度(º,c=3, 氯仿中):+199.3
20.蒸发热(KJ/mol,56.1ºC):29.11
21.熔化热(KJ/mol,15ºC):5.72
22.生成热(KJ/mol,25ºC,液体):246.98
23.燃烧热(KJ/mol,25ºC,液体):1791.0
24.比热容(KJ/(kg·K),25ºC,定压,气体):1.28
25.沸点上升常数:1.71
26.电导率(S/m,25ºC):5.8×10-8
27.热导率(W/(m·K),室温):1.9762
28.体膨胀系数(K-1,20ºC):0.00144
29.体膨胀系数(K-1,0~100ºC平均):0.00162
30.临界密度(g·cm-3):0.273
31.临界体积(cm3·mol-1):213
32.临界压缩因子:0.237
33.偏心因子:0.306
34.Lennard-Jones参数(A):5.1864
35.Lennard-Jones参数(K):148.07
36.溶度参数(J·cm-3)0.5:19.774
37.van der Waals面积(cm2·mol-1):5.840×109
38.van der Waals体积(cm3·mol-1):39.040
39.气相标准燃烧热(焓)(kJ·mol-1):-1820.7
40.气相标准声称热(焓)( kJ·mol-1) :-217.3
41.气相标准熵(J·mol-1·K-1) :295.46
42.气相标准生成自由能( kJ·mol-1):-152.8
43.气相标准热熔(J·mol-1·K-1):74.52
44.液相标准燃烧热(焓)(kJ·mol-1):-1861.5
45.液相标准声称热(焓)( kJ·mol-1):-248.1
46.液相标准熵(J·mol-1·K-1) :200.0
47.液相标准生成自由能( kJ·mol-1):-155.2
48.液相标准热熔(J·mol-1·K-1):126.6
毒理学数据
1.急性毒性[16]
LD50:5800mg/kg(大鼠经口);5340mg/kg(兔经口)
2.刺激性[17]
家兔经皮:395mg,轻度刺激(开放性刺激试验)。
家兔经眼:20mg,重度刺激。
3.亚急性与慢性毒性[18] 大鼠7.22g/m3,每天8h吸入染毒,共20个月,未发现临床及组织病理学改变。
4.致突变性[19] 细胞遗传学分析:酿酒酵母菌200mmol管。性染色体缺失和不分离:小鼠吸入12g/L。
生态学数据
1.生态毒性[20]
LC50:4740~6330mg/L(96h)(虹鳟鱼);10mg/L(48h)(水蚤);2100mg/L(48h)(卤虫)
LD50:5000mg/L(24h)(金鱼)
EC50:8600mg/L(5min)(发光菌,Microtox毒性测试);10mg/L(48h)(水蚤)
2.生物降解性[21]
好氧生物降解(h):24~168
厌氧生物降解(h):96~672
3.非生物降解性[22]
水相光解半衰期(h):270
水中光氧化半衰期(h):9.92×104~3.97×106
空气中光氧化半衰期(h):279~2790
分子结构数据
1、摩尔折射率:15.97
2、摩尔体积(cm3/mol):75.1
3、等张比容(90.2K):156.5
4、表面张力(dyne/cm):18.8
5、极化率(10-24cm3):6.33
计算化学数据
1.疏水参数计算参考值(XlogP):-0.1
2.氢键供体数量:0
3.氢键受体数量:1
4.可旋转化学键数量:0
5.互变异构体数量:2
6.拓扑分子极性表面积17.1
7.重原子数量:4
8.表面电荷:0
9.复杂度:26.3
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.无色易挥发易燃液体,微有香气。 丙酮能与水、乙醇、多元醇、酯、醚、酮、烃、卤代烃等极性和非极性溶剂相混溶,是一种典型的溶剂。除棕榈油等少数油类外,几乎所有的油脂都能溶解。并能溶解纤维素、聚甲基丙烯酸、酚醛、聚酯等多种树脂。对环氧树脂溶解能力较差,对聚乙烯、呋喃树脂、聚偏二氯乙烯等树脂不易溶解。虫胶、橡胶、沥青、石蜡等则难以溶解。本品属于微毒性,如蒸气浓度不明或超过暴露极限时,应佩带合适的呼吸器。对日光、酸碱不稳定。沸点低,挥发性大。
2.化学性质:丙酮是脂肪族酮类最有代表性的化合物,具有酮类的典型反应。例如,与亚硫酸氢钠形成无色结晶的加成物。与氰化氢反应生成丙酮氰醇[(CH3)2C(OH)CN]。在还原剂作用下生成异丙醇与频哪酮。丙酮对氧化剂化较稳定。在室温以下不会被硝酸氧化。用碱性高锰酸钾或铬酸等强氧化剂氧化时,生成乙酸、甲酸、二氧化碳和水。在碱存在下发生双分子缩合,生成双丙酮醇。2mol丙酮在各种酸性催化剂(盐酸、氯化锌或硫酸)存在下,生成亚异丙基丙酮,再与1mol丙酮加成,生成佛尔酮(二亚异丙基丙酮)。3mol丙酮在浓硫酸作用下,脱去3mol水,生成1,3,5-三甲苯。在石灰、醇钠或氨基钠存在下,缩合生成异佛尔酮(3,5,5-三甲基-2-环己烯-1-酮)。在酸或碱存在下,与醛或酮发生缩合反应,生成酮醇、不饱和酮及树脂状物质。与苯酚在酸存在下,缩合成双酚A。丙酮的α-氢原子容易被卤素取代,生成α卤代丙酮。与次卤酸钠或卤素的碱溶液作用生成卤仿。丙酮与Grignard试剂发生加成作用,加成产物水解后得到叔醇。丙酮与氨及其衍生物如羟胺、肼、苯肼等也能发生缩合反应。此外,丙酮在500~1000℃时发生热裂,生成乙烯酮。在170~260℃通过硅铝催化剂时,生成异丁烯和乙醛;300~350℃时生成异丁烯和乙酸等。
3.易燃有毒物品,毒性中等。轻度中毒对眼及上呼吸道黏膜有刺激作用,重度中毒有晕厥、痉挛,尿中出现蛋白和红细胞等症状,小鼠暴露在丙酮蒸气①30~40mg/L、②150mg/L中2小时,结果:①呈侧卧的中毒症状;②致死。人体发生中毒时,应立即离开现场,呼吸新鲜空气,重者送医院抢救。空气中最高容许浓度1000*10-6。操作现场应保持良好的通风,操作人员应穿戴防护用品。
4.丙酮属低毒类,近似于乙醇。主要对中枢神经系统有麻醉作用,吸入蒸气能引起头痛、眼花、呕吐等症状,空气中的嗅觉界限为3.80mg/m3。对眼、鼻、舌黏膜多次接触能引起炎症。蒸气浓度为9488mg/m3时,60分钟后就会呈现头痛、刺激支气管、昏迷不醒等中毒症状。嗅觉阈浓度1.2~2.44mg/m3。TJ 36-79规定车间空气中最高容许浓度为360mg/m3。
5.稳定性[23] 稳定
6.禁配物[24] 强氧化剂、强还原剂、碱
7.聚合危害[25] 不聚合
贮存方法
1.本品具高度易燃性,有严重火灾危险,属于甲类火灾危险物质。储存于阴凉干燥、良好通风处,远离热源、火源和有禁忌的物质。所有容器都应放在地面上。但久贮和回收的丙酮常有酸性杂质存在,对金属有腐蚀性。
2.用200L(53USgal)铁桶包装,每桶净重160kg,铁桶内部应清洁、干燥。贮存于干燥、通风处,温度保持在35℃以下,装卸、运输时防止猛烈撞击,并防止日晒雨淋。按防火防爆beplay体育首页 规定贮运。
3.储存注意事项[26] 储存于阴凉、通风良好的专用库房内,远离火种、热源。库温不宜超过29℃。保持容器密封。应与氧化剂、还原剂、碱类分开存放,切忌混储。采用防爆型照明、通风设施。禁止使用易产生火花的机械设备和工具。储区应备有泄漏应急处理设备和合适的收容材料。
合成方法
丙酮的生产方法较多。古老的方法是用石灰中和木材干馏所得的木醋液,制成乙酸钙,再经热分解制得丙酮。工业上研究过的合成丙酮的方法有:
(1)从乙酸得到乙酸钙,然后分解生成丙酮;
(2)乙炔在氧化锌催化剂上与水蒸气反应生成丙酮;
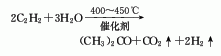
(3)乙醇蒸气在铬酸锌催化剂存在下,高温反应生成丙酮;
(4)液化天然气或石脑油氧化制丙酮(氧化产物还包括甲醛,乙酸,丁醇等);
(5)异丙醇氧化或脱氢制丙酮;
(6)异丙醇过氧化氢法制丙酮;
(7)异丙醇与丙烯醛合成丙酮;
(8)异丙苯法制丙酮,联产苯酚以丙烯和苯为原料,经烃化制得异丙苯,再以空气氧化得到氢过氧化异丙苯,然后以硫酸或树脂分解,同时得到丙酮和苯酚;
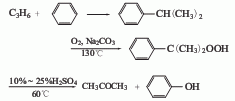
(9)丙烯直接氧化法制丙酮 工艺路线与乙烯直接氧化制乙醛法相似;
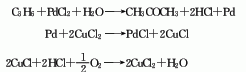
(10)对甲基异丙基苯过氧化氢法生产对甲酚,副产丙酮;(11)二异丙苯法生产氢醌,副产丙酮。但工业上实际采用的方法并不很多。目前我国用粮食发酵的生产丙酮仍占较大比重。在合成法中异丙苯法是主要的。由含淀粉的农副产品发酵,制得丙酮,丁醇和乙醇的混合物.三者的比例为丙酮:丁醇:乙醇=32:56:12至25:70:3(重量比).每生产1t丙酮,约耗用11t淀粉或60-66t废糖蜜。异丙苯法是丙酮生产路线中最经济的方法,同时得到苯酚。两者之比是,苯酚:丙酮=1:0.6(重量)。以苯酚计,10万t级装置每吨苯酚消耗丙烯(90%)590kg.
精制方法:由于制法不同,所含杂质也不同。主要杂质有水、醇、醛、醚以及微量的酸性物质等。精制时,一般用无水硫酸钙、碳酸钾、分子筛脱水后蒸馏即可。若要除去醛及其他还原性物质,可分批加入少量高锰酸钾回流,直至紫色不消失为止,再用无水硫酸钙或碳酸钾干燥后精馏;也可以用碱性硝酸银溶液与丙酮作用,过滤、干燥后蒸馏以除去有机杂质。欲得高纯度的丙酮,可将丙酮与亚硫酸氢钠作用,滤出生成的加成产物,乙醚洗涤后用碳酸钠溶液分解,无水碳酸钾干燥后蒸馏。也可以用碘化钠与丙酮反应,滤出结晶,加热即分解出纯丙酮。具体操作如下:
①在1000mL丙酮中,加入溶解有4g硝酸银的30mL水溶解和30mL1mol/L氢氧化钠溶液。搅拌10分钟后过滤,用无水硫酸钙干燥后蒸馏。
②分批加入粉末状的高锰酸钾于丙酮中,加热回流至紫色不消失为止。再加入无水硫酸钙干燥,过滤后分馏。此法适于精制大量的丙酮。
③将100g粉状碘化钠加入440g沸腾的丙酮中,用冰盐冷却到-8℃,析出碘化钠与丙酮的加成物(NaI·3C3H6O)。过滤后移入蒸馏瓶内,稍一加热即分解出纯丙酮。碘化钠可以重复使用。
丙酮在酸或碱作用下发生脱水缩合反应。因此,要得到无水物比较困难。用氯化钙、五氧化二磷、硅胶、氧化铝凝胶、硫酸钠、碳酸钾脱水时也能发生上述反应,故用无水硫酸钙或硫酸镁作干燥剂较好。
(11)工业品丙酮的主要杂质为水、醛、醇等多种有机物。可以先用灼烧过的碳酸钾、无水氯化钙或4A型分子筛脱水处理,然后加入12%的硝酸银溶液(每升丙酮加入34ml)再加入1mol/L氢氧化钠溶液(每升丙酮加入30ml)。振荡充分后静置,过滤后所得滤液用无水硫酸钙脱水干燥;若含有还原性有机物杂质,可在丙酮中分批少量加入粉末状高锰酸钾,边加热边回流,直到生成的紫色不再褪色为止,将丙酮蒸出后脱水干燥。最后于常压下控制加热温度为65~70℃进行蒸馏,收集55~57℃馏分,即为成品。
用途
1.丙酮为代表性的低沸点、快干性极性溶剂。溶解能力强,又溶于水,除用作涂料、清漆、硝基喷漆等溶剂外,尚用作纤维素、醋酸纤维素、照相胶片等制造时的溶剂和脱漆剂。丙酮能萃取各种维生素与激素及石油脱蜡。丙酮还是重要的化工原料,用于制造乙酐、甲基丙烯酸甲酯、双酚A、亚异丙基丙酮、甲基异丁基甲酮、己二醇、氯仿、碘仿、环氧树脂、维生素C等。并用作萃取剂、稀释剂等。
2.用于制取有机玻璃单体、双酚A、二丙酮醇、己二醇、甲基异丁基酮、甲基异丁基甲醇、佛尔酮、异佛尔酮、氯仿、碘仿等重要有机化工原料。在涂料、醋酸纤维纺丝过程、钢瓶贮存乙炔、炼油工业脱蜡等方面用作优良的溶剂。在医药工业,是维生素C和麻醉剂索佛那的原料之一,也用作各种维生素和激素生产过程中的萃取剂。在农药工业,丙酮是合成丙烯拟除虫菊酯的原料之一。
3.用作分析试剂,如作溶剂。用作色谱衍生物试剂及液相色谱洗脱剂。
4.用于电子工业,常用作清洗去油剂。
5.常用作乙烯基树脂、丙烯基树脂、醇酸漆、醋酸纤维素以及多种胶黏剂的溶剂。还广泛用于醋酸纤维素、胶片、薄膜和塑料的制造,也是生产甲基丙烯酸甲酯、甲基异丁基酮、双酚A、乙酸酐、乙烯酮以及呋喃树脂的原料。
6.可用作稀释剂、洗涤剂以及维生素、激素类的萃取剂。
7.是基本的有机原料和低沸点溶剂。[27]
安全信息
危险运输编码:UN 1090 3/PG 2
危险品标志: 易燃
易燃  有毒
有毒  刺激
刺激
安全标识:S9 S16 S23 S26 S33 S45 S36/S37
危险标识:R11 R36 R66 R67 R23/24/25 R39/23/24/25
文献
[1~27]参考书:危险beplay体育首页 安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无









 沪公网安备 31010602001115号
沪公网安备 31010602001115号