| 物竞编号 | 0K04 |
|---|---|
| 分子式 | H2O2 |
| 分子量 | 34.02 |
| 标签 | 双氧水, 配合掩蔽剂, 显色剂, 漂白剂, 强氧化剂, 破胶剂, 杀菌剂 |
编号系统
CAS号:7722-84-1
MDL号:MFCD00011333
EINECS号:24895576
RTECS号:MX0899000
BRN号:3587191
PubChem号:24895576
物性数据
1.性状:无色透明液体,有微弱的特殊气味。[1]
2.熔点(℃):-0.4[2]
3.沸点(℃):150.2[3]
4.相对密度(水=1):1.46(无水)[4]
5.相对蒸气密度(空气=1):1[5]
6.饱和蒸气压(kPa):0.67(30℃)[6]
7.临界压力(MPa):20.99[7]
8.辛醇/水分配系数:-1.36[8]
9.溶解性:溶于水、乙醇、乙醚,不溶于苯、石油醚。[9]
毒理学数据
1.急性毒性[10] LD50:浓度为90%,376mg/kg(大鼠经口)
2.刺激性[11] 家兔经眼:90%,1mg,重度刺激。
3.致突变性[12] 微生物致突变:鼠伤寒沙门菌6μg/皿。姐妹染色单体交换:仓鼠肺353μmol/L。DNA损伤:人成纤维细胞28μmol/L;人淋巴细胞100μmol/L。程序外DNA合成:人成纤维细胞1mmol/L。
4.致癌性[13] IARC致癌性评论:G3,对人及动物致癌性证据不足。
生态学数据
1.其它有害作用:爆炸性强氧化剂。过氧化氢本身不燃,但能与可燃物反应放出大量热量和氧气而引起着火爆炸。过氧化氢在pH值为3.5~4.5时最稳定,在碱性溶液中极易分解,在遇强光,特别是短波射线照射时也能发生分解。当加热到 100℃以上时,开始急剧分解。它与许多有机物如糖、淀粉、醇类、石油产品等形成爆炸性混合物,在撞击、受热或电火花作用下能发生爆炸。过氧化氢与许多无机化合物或杂质接触后会迅速分解而导致爆炸,放出大量的热量、氧和水蒸气。大多数重金属(如铁、铜、银、铅、汞、锌、钴、镍、铬、锰等)及其氧化物和盐类都是活性催化剂,尘土、香烟灰、碳粉、铁锈等也能加速分解。浓度超过74%的过氧化氢,在具有适当的点火源或温度的密闭容器中,能产生气相爆炸。
2.生态毒性[14]
LC50:37.4mg/L(96h)(鲶鱼);16.4mg/L(96h)(黑头呆鱼);42mg/L(48h)(鲤鱼);
EC50:2.4mg/L(96h)(水蚤)
3.生物降解性 暂无资料
4.非生物降解性 暂无资料
分子结构数据
1、摩尔折射率:5.11
2、摩尔体积(cm3/mol):23.5
3、等张比容(90.2K):65.6
4、表面张力(dyne/cm):60.2
5、极化率(10-24cm3):2.02
计算化学数据
1.疏水参数计算参考值(XlogP):-0.9
2.氢键供体数量:2
3.氢键受体数量:2
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积40.5
7.重原子数量:2
8.表面电荷:0
9.复杂度:0
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.极不稳定,遇热、光、粗糙表面、重金属及其他杂质会引起分解,同时放出氧和热。具有较强的氧化能力,为强氧化剂。在有酸存在下较稳定,有腐蚀性。高浓度的过氧化氢能使有机物质燃烧。与二氧化锰相互作用,能引起爆炸。工作接触时要穿防护衣,戴聚乙烯或聚氯乙烯制的手套和聚合材料制的透明防护眼镜和面具。如触及皮肤或溅入眼睛用温水冲洗。30%的水溶液的熔点为-32.6℃,沸点107℃,相对密度1.132。过氧化氢具有强氧化性,但在某些场合也可以作为还原剂。高浓度过氧化氢溶液可因杂质或金属粉而引起爆炸性分解。另外,高浓度过氧化氢与皮肤接触时,会引起水肿,所以一旦皮肤接触到高浓度过氧化氢时应立即用大量水冲洗。
2.能与水醇任意混溶,水溶液具弱酸性。有氧化性。有腐蚀性,能引起灼伤。贮存时会分解为水和氧,可加入少量乙酰基苯胺、乙酰基乙氧基苯胺作稳定剂。本品具有腐蚀性,其液体如溅在皮肤上很快会呈现白色并具有灼伤感,其气体则会刺激眼睛和肺部。
3.过氧化氢的化学性质有弱酸性、氧化性、还原性不稳定性。过氧化氢既有氧化性也有还原性,其中又以氧化性为主;过氧化氢遇强氧化剂时,发生还原反应;过氧化氢在发生氧化反应或还原反应时,其本身都不给环境造成杂质,因此,过氧化氢是某些物质制备和除杂质时较为理想的氧化剂或还原剂。
4.高浓度的过氧化氢溶液和蒸气对人体都有较强的刺激性作用和腐蚀性。含量在30%以上的溶液接触皮肤,会使之变白并有刺痛感;接触眼睛能引起炎症,甚至灼伤。含量在50mg/kg以上的蒸气能强烈刺激眼睛和黏膜,并引起呼吸器官障碍。人体在过氧化氢蒸气中短时间曝露的浓度界限为75mg/kg,超过100mg/kg时则有生命危险。应使用大量水冲洗身体接触部位。浓度低于86%的工业过氧化氢,只要条件符合要求,在常温下是不会爆炸的。浓度高于86%的产品,也只有存在高能引发源时才能发生爆炸。蒸气相过氧化氢在一条件下会发生爆炸。其在大气压力下的爆炸极限浓度约为26mol/m3。含有90%H2O2的气相,只要保持在115℃以下是安全的。
5.稳定性[15] 不稳定
6.禁配物[16] 易燃或可燃物、强还原剂、铜、铁、铁盐、锌、活性金属粉末
7.避免接触的条件[17] 强光、受热、撞击
8.聚合危害[18] 不聚合
9.分解产物[19] 氧气、水
贮存方法
储存注意事项[20] 储存于阴凉、干燥、通风良好的专用库房内,远离火种、热源。库温不超过30℃,相对湿度不超过80%。保持容器密封。应与易(可)燃物、还原剂、活性金属粉末等分开存放,切忌混储。储区应备有泄漏物应急处理设备和合适的收容材料。
合成方法
1.电解法有过硫酸铵法、过硫酸钾法和过硫酸法三种。工业上主要采用过硫酸铵法,该法具有电流效率高、工艺流程短、电耗低等优点。
(1)过硫酸铵法:电解硫酸氢铵水溶液,生成含量为180~240 g/L的过硫酸铵,在减压下进行水解,蒸馏,浓缩分离,除去酸雾,然后经精馏,制得过氧化氢,控制过氧化氢成品浓度为27.5%。其反应式:

(2)有机法有蒽醌法和异丙醇法两种。蒽醌法技术成熟,目前国内外基本上采用该法。异丙醇法在我国曾进行过试验,但未实现工业化。
蒽醌法:烷基蒽醌(二乙基蒽醌)与有机溶剂(氢化萜松醇、磷酸三辛酯和重芳烃)配制成工作溶液,在压力为3.03×105 Pa、温度为55~65℃、有催化剂存在的条件下,通入氢气进行氢化,再在40~44℃下与空气(或氧气)进行逆流氧化,经萃取、净化制得过氧化氢成品。
异丙醇法:以异丙醇为原料,以过氧化氢或其他过氧化物为引发剂,用空气(或氧气)进行液相氧化,生成过氧化氢和丙酮,经蒸发,使过氧化氢同有机物及水分分离,再经有机溶剂萃取净化,即得过氧化氢成品。此法同时可副产丙酮。其

过氧化氢的提纯方法:用离子交换树脂处理过氧化氢水溶液可使其得到深度提纯。所用的离子交换树脂是事先经专门处理的。将树脂装满玻璃柱,先用10%的盐酸洗到流出液中不含Fe3+(用硫氰酸铵溶液检验),再用蒸馏水洗到流出液呈中性,然后用蒸馏过的乙醇洗到滤液无色,最后再用水洗到无乙醇味为止。阳离子交换树脂卸出后可放在空气中干燥。阴离子交换树脂还要用5%的氢氧化钠溶液处理,直至流出液中无Cl-离子为止,最后用蒸馏水洗涤至中性。1L过氧化氢中加入经上述过程处理的阳离子交换树脂10g和阴离子交换树脂15g,搅拌15min(不要超过),然后用无灰滤纸过滤。这样可制得纯度很高的H2O2。其中不挥发物含量为10-3%,硫酸盐含量小于3×10-4%,游离酸小于10-3%。采用蒸馏的方法可以得到H2O2的浓溶液,含量可达90%或100%。
2.制法 先用10%的硫酸溶液充分洗涤强酸性磺酸基阳离子交换树脂至不含铁(用硫氰酸钾检验),然后用水洗至无SO42-离子存在(用氯化钡检验),将160g处理过的树脂装入直径7.6cm的玻璃柱中。然后让pH=0.7-1.5的工业品过氧化氢在室温下通过装有树脂的交换柱,控制流速为每分钟有1mL的溶液流过1g树脂,即可得试剂过氧化氢。树脂的再生和预处理一样:用10%硫酸溶液洗涤,再水洗至合格。若要制备较浓溶液,可采用蒸馏方法,以得到90%或100%的过氧化氢成品。
用途
1.化学工业上用作制造过硼酸钠、过碳酸钠、过氧乙酸、亚氯酸钠、过氧化硫脲等无机或有机过氧化物的原料;用于生产金属盐类或其他化合物以除去铁及其他重金属;用于电镀液中以除去无机杂质,提高镀件质量。
2.在医药上主要用作杀菌剂。用作羊毛、生丝、皮毛、羽毛、象牙、猪鬃、纸浆、脂肪等的漂白剂。还可用作食品加工、食品的漂白、防腐和保鲜剂。近年来广泛用于纸塑无菌包装材料在包装前杀菌之用。用于工业污水、污泥处理,是生态业理想的污染控制剂。高浓度的过氧化氢可作为火箭燃料和氧源。
3.电子工业中用作清洗腐蚀剂。
4.该产品也应用于污水处理的脱臭,杀菌灭藻,也广泛应用在纺织印染及造纸工业作漂白剂及食品工业作漂白保鲜剂。
5.过氧化氢可用于除去电镀溶液的有机杂质,也可用于铜、低碳钢的化学抛光及铜的化学蚀刻。
6.用于漂白、医药,也用作分析试剂。[21]
安全信息
危险运输编码:UN 2014 5.1/PG 2
危险品标志: 有害
有害
文献
[1~21]参考书:危险beplay体育首页 安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无

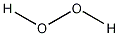



 沪公网安备 31010602001115号
沪公网安备 31010602001115号