| 物竞编号 | 01PT |
|---|---|
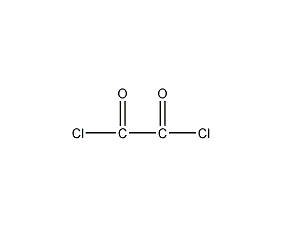
| 分子式 | C2Cl2O2 |
| 分子量 | 126.92 |
| 标签 | 乙二酰氯, Ethanedioyl dichlorid |
编号系统
CAS号:79-37-8
MDL号:MFCD00000704
EINECS号:201-200-2
RTECS号:KI2950000
BRN号:1361988
PubChem号:24853204
物性数据
1. 性状:无色发烟液体
2. 相对密度:1.488
3. 相对蒸汽密度(g/mL,空气=1):不确定
4. 熔点(ºC):-12
5. 沸点(ºC,常压):63-64
6. 沸点(ºC,5.2kPa):不确定
7. 折射率:1.4340(13℃)
8. 闪点(ºC):不确定
9. 比旋光度(º):不确定
10. 自燃点或引燃温度(ºC):不确定
11. 蒸气压(kPa,25ºC):不确定
12. 饱和蒸气压(kPa,60ºC):不确定
13. 燃烧热(KJ/mol):不确定
14. 临界温度(ºC):不确定
15. 临界压力(KPa):不确定
16. 油水(辛醇/水)分配系数的对数值:不确定
17. 爆炸上限(%,V/V):不确定
18. 爆炸下限(%,V/V):不确定
19. 溶解性:溶于乙醚,遇水及醇能剧烈分解。加热至约600℃即分解并逸出一氧化碳。溶于正己烷、苯、乙醚、乙腈和卤代溶剂如二氯甲烷、氯仿。
毒理学数据
1、急性毒性 大鼠吸入LC50:1840ppm/4H
生态学数据
暂无
分子结构数据
1、 摩尔折射率:21.07
2、 摩尔体积(cm3/mol):78.5
3、 等张比容(90.2K):198.7
4、 表面张力(dyne/cm):40.9
5、 极化率(10-24cm3):8.35
计算化学数据
1.疏水参数计算参考值(XlogP):1.7
2.氢键供体数量:0
3.氢键受体数量:2
4.可旋转化学键数量:1
5.互变异构体数量:无
6.拓扑分子极性表面积34.1
7.重原子数量:6
8.表面电荷:0
9.复杂度:75.5
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.草酰氯不仅对空气敏感,遇到潮气会发生分解放出氯化氢,而且有一种不愉快的味道。
2.草酰氯具有高毒性和腐蚀性,能严重刺激眼睛、皮肤和呼吸道。盛放草酰氯的试剂瓶必须在阴凉、干燥的环境下保存,并严格密封,严禁与湿气接触。草酰氯与水能剧烈反应,放出毒性气体CO、CO2和HCl。
贮存方法
本品应密封于阴凉避光处保存。
合成方法
将无水草酸与五氯化磷混匀后,慢慢加热至64℃左右,反应至无氯化氢止。将粗品精馏后即得草酰氯。
用途
1.用于合成苯甲酰脲类杀虫剂氟铃脲、杀铃脲等的中间体,也是磺酰脲类除草剂甲磺隆、苄嘧磺隆、吡嘧磺隆等的中间体。
2.草酰氯是一个应用广泛的制备碳酰氯、磷酰二氯、氯代烷烃以及酰基异氰的酰化试剂。
草酰氯是一个非常有效的酰化试剂,能广泛用于制备酰基叠氮化物、溴代烯烃、碳酰胺、邻二氮萘、偶氮酮、内酯,以及实现乙烯酮的环加成反应,分子内Fridel-Crafts酰化反应。
与亚硫酰氯相似,草酰氯与酸作用会给出气体副产物,生成的氯化物能很容易分离出来 (式1)[1]。
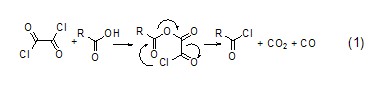
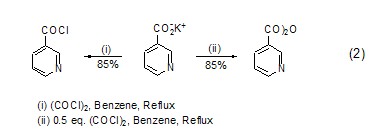
草酰氯与羧酸根离子的作用机理包括亲核取代、分子内电荷转移,从而形成相应的酰氯产物。通过调整草酰氯与羧酸根离子的比例还可以得到酸酐化合物 (式2)[2]。
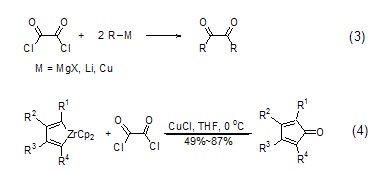
草酰氯与金属有机化合物如格氏试剂,烷基锂作用生成邻二羰基化合物 (式3)[3]。草酰氯与锆杂环戊二烯在CuCl的作用下生成环戊二烯酮衍生物 (式4)[4]。
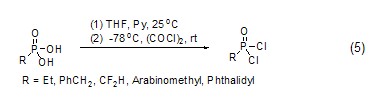
草酰氯能用于制备磷酰氯衍生物,如磷酸在草酰氯和吡啶作用下在低温能高产率地转换为相应的磷酰氯 (式5)[5]。
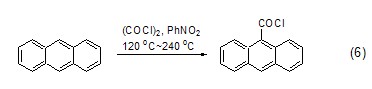
草酰氯还能直接为烷烃或环烷烃化合物引入氯羰基团,不过通常反应得到的是混合物。芳香烃化合物在草酰氯和路易斯酸作用下也能发生氯羰基化反应,其中,蒽在没有催化剂存在下也能直接发生反应 (式6)[6]。
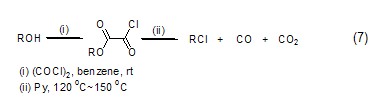
醇类化合物与草酰氯反应能得到乙二酰单烷基酯,进而在加热条件下转变为氯代烷烃化合物 (式7)[7]。
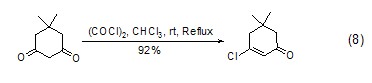
草酰氯与于1,3-二酮反应,能高产率地生成β-氯烯烃环化物 (式8)[8]。
安全信息
危险运输编码:UN 2922 8/PG 1
危险品标志: 腐蚀
腐蚀
安全标识:S26 S43 S45 S36/S37/S39
文献
1. (a) Adams, R; Ulich, L. H. J. Am. Chem. Soc., 1920, 42, 599. (b) Paquette, L. A.; Dahnke, K.; Doyon, J.; He, W.; Wyant, K.; Friendrich, D. J. Org. Chem., 1991, 56, 6199. 2. (a) Wingfield, H. N.; Harlan, W. R.; Hanmer, H. R. J. Am. Chem. Soc., 1953, 75, 4364. (b) Schrecker, A. W.; Haury, P. B. J. Am. Chem. Soc., 1954, 76, 5803. 3. (a) Larock, R. C. In Comprehensive Organic Transformations; VCH: New York, 1989. (b) O’Niel, B. T. In Comprehensive Organic Synthesis, 1991, Vol. 1; 397. (c) Shirley, D. A. Org. React., 1954, 8, 28. (d) Jorgenson, M. J. Org. React., 1970, 18, 1. (e) Faust, R.; Weber, C.; Fiandanese, V.; Marchese, G.; Punzi, A. Tetrahedron, 1997, 53, 14655. (f) Faust, R.; Weber, C. J. Org. Chem., 1999, 64, 2571. 4. Chen, C.; Xi, C.; Jiang, Y.; Hong, X. J. Am. Chem. Soc., 2005, 127, 8024. 5. Stowell, M. H. B.; Ueland, J. M.; McClard, R. W. Tetrahedron Lett., 1990, 31, 3261. 6. Latham, H. G.; May, E. L.; Mosettig, E. J. Am. Chem. Soc., 1984, 70, 1079. 7. Rhoads, S. J.; Michel, R. E. J. Am. Chem. Soc., 1963, 85, 585. 8. (a) Clark, R. D.; Heathcock, C. H.; J. Org. Chem., 1976, 41, 636. (b) Buchi, G.; Carlson, J. A. J. Am. Chem. Soc., 1969, 91, 6470. 9.参考书:现代有机bepaly tw <性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无





 沪公网安备 31010602001115号
沪公网安备 31010602001115号